A día de hoy la mayoría de la gente
conoce de la existencia de los átomos, o debería. En muchos centros se enseñan en bachillerato y hasta en la ESO, pero casi nadie sabe cómo son realmente los átomos. Desde las empresas de química o tecnología hasta los profesores de instituto o los dibujos animados, el 90% de las representaciones y dibujos de
los átomos nos muestran unas ideas que dejamos atrás hace más de 100 años. Un poco de historia sobre el átomo
La típica representación de un átomo con
un núcleo formado por protones y neutrones y los electrones girando a su alrededor se estableció a principios del siglo pasado a raíz de un experimento realizado por
Ernest Rutheford. El experimento, que se realizó en 1911, demostró la existencia de un núcleo interno donde se concentraba prácticamente toda la masa del átomo. Dos años después Niels Bohr postuló que estás órbitas tenía que tener un tamaño concreto para que el electrón pudiera girar siguiéndose esa órbita, sentando así
las bases de la mecánica cuántica.
Y este es el modelo que
dibujan y dibujamos todos hoy. La imagen que nos viene a la cabeza cuando pensamos en un átomo y que utilizan muchas empresas es sus logotipos o promociones, una imagen con más de 100 años de antigëedad. Hasta aquí no hemos abordado el problema real, y para ello basta con
avanzar 12 años, hasta 1925, en nuestro repaso histórico, hasta la aceptación de la ecuación de Schrödinger. Ecuación que es indiscutiblemente
una de las 5 ecuaciones más importantes en Física.
En 1925 Erwin Schrödinger presentó al mundo su ecuación, que a
posteriori sería
la piedra angular de la mecánica cuántica. Esta ecuación trae un montó de regalos escondidos, y uno de ellos es la imagen más real de un átomo que tenemos hasta la fecha. Lo que en realidad sucede es que, en lugar de seguir una trayectoria definida como creíamos,
siguen todas las trayectorias, pero cada una con distinta probabilidad.
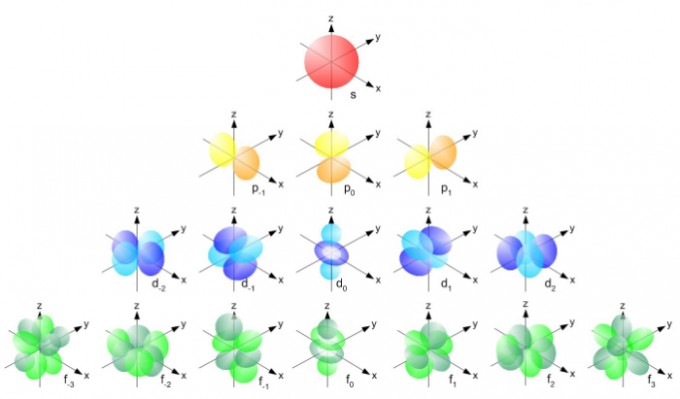
Representación de la forma de un átomo en función del número de electrones
Esto que
suena tan extraño, y que lo es, es también el punto de partida de todas las teorías y leyes cuánticas. Dudo mucho que exista alguien en este mundo al que la cuántica le parezca intuitiva o la entienda por completo, pero para comenzar a entender este cambio entre electrón y probabilidades, os recomiendo
repasar la paradoja del gato de Schrödinger, que se creó para este fin.
Por qué esto es buenoEs decir, si quisiéramos ser rigurosos, deberíamos
dibujar los átomos como un punto central rodeado por una serie de nubes de probabilidad (cada una con una forma diferente), donde la opacidad representaría la posibilidad de encontrar un electrón en ese punto. Como podéis imaginar,
además de feo sería un auténtico caos. Y es esto lo que no se lleva directamente a la segunda parte del título de esta entrada:
No está mal dibujar los átomos de forma errónea.
Esos dibujos de átomos
son una representación bonita, cómoda, práctica y sencilla. Podríamos decir que es a los átomos lo que los monigotes de palitos a los humanos.
No pretenden ser fieles ni realistas, sino transmitir un concepto de forma clara y directa sin necesidad de prestar atención a todos los detalles y sin que el receptor necesite unos
grandes conocimientos de física.

Comentario: