Un nuevo estudio publicado en Translation Medicine Online1 señala los riesgos de desarrollar esclerosis lateral amiotrófica (ELA) debido a la reactivación de retrovirus endógenos (ERV) presentes en el genoma humano, un elemento genético móvil que se cree son restos de antiguas infecciones retrovirales. Hasta hace poco, se creía que los ERV formaban parte del denominado ADN redundante o ADN basura, pero se está descubriendo que tiene una importante función fisiológica.
La idea de que estos elementos móviles actúan movidos por una conducta egoísta está perdiendo terreno frente a las evidencias que muestran que se trata en realidad de socios simbióticos que se integraron en el genoma humano hace millones de años. La actividad anormal de los retrovirus endógenos se está relacionando con muchas enfermedades, entre ella la ELA, cánceres, enfermedades autoinmunes, tales como la artritis y el lupus psoriasiforme, diabetes y VIH.
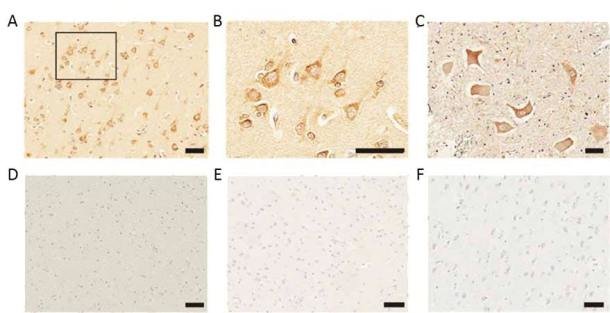
La introducción en ratones de secuencias retrovirales endógenas presentes en cerebros de pacientes con ELA, induce síntomas de ELA
La ELA (también conocida como enfermedad de la neurona motora, enfermedad de Lou Hehring o enfermedad de Charcot) se caracteriza por la degeneración progresiva de las neuronas motoras, dando lugar a la pérdida de masa muscular y la eventual muerte debida a la insuficiencia de los músculos respiratorios. La causa de la enfermedad aún no se comprende, aunque una pequeña proporción de casos (5% al 10%) se debe a mutaciones genéticas.
Se venía sospechando desde la década de 1970 que las infecciones virales jugaban un importante papel en la aparición de la ELA, hasta que se observaron evidencias de expresión retroviral en los cerebros de pacientes con ELA, y se ha propuesto en este nuevo estudio que en lugar de considerar una infección por virus exógenos, se tenga en cuenta la activación de retrovirus endógenos presentes en el genoma humano.
El estudio dirigido por Avindra Nath de los Institutos Nacionales de Salud de Estados Unidos, ahonda en una observación anterior, cuando el tratamiento de uno de sus pacientes con VIH, que también sufría la ELA, con medicamentos antirretrovirales, dio lugar a la reversión de los síntomas de la ELA2. La transcriptasa inversa, una enzima asociada principalmente con retrovirus que transcribe ADN a partir de ARN (proceso que define un retrovirus), también se encontró previamente en la sangre de pacientes con la ELA, sin que se observasen retrovirus exógenos3-7.
En el análisis postmortem de los cerebros de 16 pacientes con la ELA y de 11 controles sin evidencia de neurodegeneración, los investigadores encontraron una expresión muy alta de retrovirus endógenos humanos (HERV). Una familia en particular, denominada HERV-K, estaba altamente expresada en las neuronas piramidales de los pacientes con otras enfermedades neurológicas.
Para comprobar el papel funcional del aumento de la expresión de HERV-K en los cerebros humanos de pacientes con la ELA, los investigadores injertaron cultivos de células neuronales humanas con HERV-K. Las neuronas que expresan HERV-K mostraban signos patológicos, que dependían del número de células injertadas, así como la longitud de las neuritas (proyecciones del cuerpo celular de una neurona). Se encontraron resultados similares cuando se activaron HERV-K endógenos en cultivos de células neuronales mediante la introducción de un promotor transgénico para impulsar su expresión mediante la técnica de edición genética CRISPR/Cas9.
Del mismo modo, en ratones la introducción del gen HERV-K en el cerebro de los embriones, resultó en una reducción en la longitud y complejidad de las dendritas (proyecciones neuronales): las reducción de las espinas dendríticas en forma de hongo, así como el aumento de las espinas dendríticas cortas (las espinas neuronales cortas y en forma de hongo son diferentes clases de dendritas que forman la columna vertebral). Los animales transgénicos que expresan HERV-K también mostraron la degeneración específica de las neuronas de la ELA, sin una reducción neuronal total, pero sí una reducción de las células Ctip2-positivas. Ctip2 se utilizan como un marcador para neuronas motoras corticoespinales. Había una ausencia casi total de neuronas motoras en el asta anterior de la médula espinal y una reducción significativa (22%) en el espesor de la corteza motora, pero no se observó ninguna diferencia en otras regiones del cerebro, tales como el hipocampo, cuerpo calloso o corteza cingulada. Los ratones mostraron un aumento de la lesión neuronal, medida por el aumento en los daños producidos en el ADN. Los cambios de comportamiento coinciden con síntomas de la ELA; los ratones afectados muestran una disminución progresiva de la función motora de los 3 los 6 meses de edad y una tasa de mortalidad del 50% a los 10 meses de edad.
Estudiando el mecanismo de la elevada expresión de HERV-K, los investigadores encontraron que la proteína de unión al ADN, TDP-43 (TAR-DNA-Binding protein-43) controla la expresión de HERV-K cuando se injerta en cultivos neuronales. TDP-43 se viene relacionando desde hace mucho tiempo con la ELA y es conocido por regular los retrovirus tales como el del VIH, y también se une a elementos de transposición. Su patrón de expresión se había demostrado previamente que está correlacionado con el HERV-K según estudios realizados postmortem en cerebros de pacientes con la ELA. Más de 30 mutaciones en esta proteína ya se habían relacionado con la ELA y otras enfermedades neurodegenerativas de demencia frontotemporal (FTLD), habiéndose encontrado agregados de esta proteína en los cerebros con pacientes con la ELA, una característica patológica de la ELA y de otras enfermedades neurodegenerativas. Incluso la sobreexpresión de tipo TDP-43 es suficiente para inducir degeneración de las neuronas motoras en los ratones. La activación de HERV-K por la proteína TDP-43 proporciona una nueva relación mecanicista entre TDP-43 y la ELA.
Tamaño de las barras, 50 mm
Se considera que estos pequeños virus se integraron en el genoma humano hace unos 30 a 40 millones de años, y ahora se transmiten de generación en generación en forma mendeliana, encontrándose en el genoma de todas las células. Hay diferentes tipos de retroelementos en el genoma humano, además de los retrovirus, los denominados LINES (elementos largos intercalados) y SINES (elementos cortos intercalados), que tienen importantes funciones fisiológicas. Los HERVs constituyen aproximadamente el 8% del genoma humano, y si incluimos los fragmentos de HERV y derivados, el legado retroviral supondría aproximadamente la mitad de nuestro ADN2,3.
Su estructura genómica es similar a los retrovirus exógenos, y se componen de tres genes: gag, pol y env, entre dos regiones de repeticiones terminales largas (LTR) (ver Figura 2). Los LTRs son secuencias idénticas que se repiten cientos o miles de veces y se utilizan para insertar su material genético en el genoma del huésped. También son el centro de control de la expresión génica, llevando todos los componentes necesarios para la expresión de los genes. Las proteínas gag son los principales componentes de la cápside viral, mientras que las proteínas pol son las responsables de la síntesis del ADN viral y la integración en el genoma viral; y las proteínas env juegan un papel en la asociación y entrada partículas virales en la célula huésped. La mayoría de los HERVs son defectuosos, incapaces de replicarse debido a mutaciones en su genética. Los HERV-K sí son capaces de generar partículas virales. Hay más de 26 familias de HERVs identificadas, y aunque la mayoría se han convertido en defectuosas debido a mutaciones y delaciones en sus secuencias, la familia HERV-K produce partículas virales intactas.
Los HERVs de los elementos móviles son de particular interés debido a que sus componentes de regulación están situados dentro de las regiones LTR. Los elementos reguladores pueden inducir y mediar en la expresión de genes virales, así como la expresión de genes muy próximos en el huésped humano. Tales elementos reguladores incluyen promotores de genes, potenciadores, señales de poliadenilación, aisladores, así como sitios de unión para diversas proteínas nucleares, incluidos los factores de transcripción. Los genes HERV también tienen el potencial de integrarse en cualquier parte del genoma, por lo tanto, la de alterar la estructura genómica. Se ha sugerido que proporcionan secuencias que permiten alteraciones genómicas, en lo que se ha descrito como "ingeniería genética natural"9. Son una fuente de la nueva codificación genética y de la información no codificante utilizada por los ARN no codificantes, señales de empalme de reordenamientos genómicos, así como importantes elementos para el control epigenético del genoma. De hecho, la investigación bioinformática más reciente ha identificado alrededor de 110.000 elementos HERV activos de regulación en los alrededor de 320.000 sitios de enlace transcripcional10.
Las evidencias de su funcionalidad provienen de estudios en humanos, que muestran que el 30% de los individuos sanos están expresando genes HERV, observándose un aumento de su producción en la placenta y tejidos embrionarios, en consonancia con la identificación de los elementos de respuesta hormonal en sus regiones reguladoras. De hecho, los HERVs han coevolucionado con el genoma humano y juegan importantes funciones moleculares, incluyendo el desarrollo de la placenta en los mamíferos a través de la expresión de la proteína syncytin, a partir del gen env de HERV-W, implicado en la fusión de los citotrofoblastos de la placenta para forma una de las capas de la placenta, denominada capa sincitial, que es vital para la supervivencia de los embriones11.
Un ejemplo de su papel como reguladores de la transcripción, proviene de estudios realizados en el hipocampo (región del cerebro que es esencial para el aprendizaje y la memoria). Los elementos potenciadores (implicados en la activación transcripcional de genes) intervienen en la expresión del PRODH del hipocampo, creado a través de la inserción de un LTR de HERV-K. La expresión anormal de HERVs se ha relacionado con la esquizofrenia, la depresión y el trastorno bipolar, con cerebros de pacientes que mostraron una expresión reducida de HERV-W en comparación con los cerebros sanos, lo que sugiere una pérdida de funcionalidad en lugar de sobreactivación de los retrovirus en este escenario12. Otra familia HERV, la HERV-H, que se expresa preferentemente en las células madre, recientemente se demostró que intervenía en la programación de las células madre a través de los transcriptores de RNA no codificante13. Otros retroelementos endógenos, tales como los elementos cortos (SINES), también se han implicado en el desarrollo del cerebro14.
Medidores ambientales de la actividad de los HERV
Mientras que algunos HERVs, tales como la familia HERV-K, parecen expresarse en condiciones saludables, la mayoría son silenciados por mutación o bien controlados epigenéticamente a través de la metilación del ADN o modificaciones de la cromatina. Sin embargo, algunos estudios han encontrado que los estímulos ambientales pueden inducir una activación anormal, relacionada con condiciones patológicas. Ejemplos de esto puede ser la activación microbiana, así como la activación de las infecciones virales agudas, tales como el virus VIH, virus de Epstein-Barr, el herpevirus 6, y citomegalovirus humanos. De hecho, un reciente estudio aparecido en Nature descubrió que los ratones que están inmunocomprometidos mostraban una activación de los ERV, pero esta activación no se produjo cuando los ratones fueron colocados en condiciones libres de gérmenes asociados con una reducida o ausencia de microbiota15. Esto parece sugerir una intrincada relación simbiótica entre la inmunidad y el control de ERV, proporcionando una relación mecanicista entre la activación inmune y las patologías.
Otros factores ligados a la activación de los HERV están relacionados con las citoquinas proinflamatorias como la interleucina 1β, factor α de necrosis tumoral e interferón α, este último se ha demostrado que induce la expresión de superantígenos HERV-K. Los superantígenos son productos microbianos que tienen la capacidad de promover una respuesta inmune, implicados en la autoinmunidad. Las infecciones virales se han asociado con la autoinmunidad y los retrovirus endógenos, por lo tanto, otro posible mecanismo subyacente a muchos enfermedades inmunes cuando se carece de pruebas de infecciones exógenas.
Los plaguicidas organofosforados, las hormonas esteroideas, factores mutágenos del ADN como la radiación UVB, infecciones bacterianas y el ácido retinoico, todos ellos han mostrado que activan la expresión de HERV16 (Ver: Retrovirus Endógenos y Enfermedades Crónicas, SiS 19). Se ha demostrado que otros factores, como la hipoxia, pueden reducir la expresión de las proteínas HERV.
Desencadenantes ambientales, HERVs y ELA
Factores ambientales adicionales relacionados con la ELA son el tabaquismo, exposición a sustancias químicas en muchos trabajos, como las tareas agrícolas, trabajadores del caucho y del cuero; y la exposición a metales (plomo, hierro y selenio a menudo se incrementan en pacientes con ELA, así como en condiciones médicas tales como cáncer, neuroinflamación y traumatismo craneal17. Sería de gran interés investigar más a fondo si alguno de estos factores de riesgo están asociados con la inducción de la actividad anormal de HERV. Como se mencionó anteriormente, la activación de HERVs por exposición a sustancias químicas en un entorno agrícola puede deberse a la presencia de organofosforados, mientras que los disruptores endocrinos también pueden ser un factor, ya que los HERVs tienen elementos de respuesta hormonal en sus genomas. La neuroinflamación, las infecciones con numerosos agentes patógenos, así como la disbiosis del microbioma pueden tener todos ellos influencia en la actividad de los HERVs.
Comentario: Para un mejor análisis acerca del tabaco y sus efectos en la salud, le recomendamos leer:
Conclusión
La activación de los retrovirus endógenos, muy abundantes en el genoma humano, está íntimamente relacionada con la evolución humana y añade otra capa de complejidad a la relación simbiótica existente en nuestros cuerpos, el medio ambiente y los virus antiguos, que son vitales para la fisiología humana y la supervivencia.
(Nota: las tablas, así como las referencias bibliográficas, sólo se pueden consultar estando registrado en el sitio web de IsiS)
Procedencia del artículo: Ancient Viral Genes in Human Genome Reactivated in Human Disease





Comentario: Ésto nos hace ver que realmente existe mucha complejidad en lo que respecta a nuestra salud y que el ambiente tóxico en el que vivimos nos afecta de maneras que sin duda están contribuyendo al aumento de enfermedades que vemos hoy en día. Infecciones exógenas y endógenas, además de los mismos problemas causados por la intoxicación por metales, haluros, pesticidas, smog, aditivos alimenticios y una infinidad de elementos que agregar a la lista de toxicidad actual; todo eso nos lleva a necesitar varias vías de desintoxicación para poder recuperar nuestra salud y vivir lo mejor posible ante tales circunstancias.
Le recomendamos leer: