Comentario: No te pierdas nuestro especial sobre las grasas:
El uso de dietas cetogénicas (KD) está ganando popularidad actualmente, especialmente en el ámbito médico. La satanización de las grasas gracias a la hipótesis de los lípidos hizo que se desprestigiara el uso de KD como la popularizada por Atkins y se alarmó de los posibles peligros que producía llevar este régimen de alimentación. Con el tiempo y con la tasa de enfermedades crónicas causadas, en parte, por el fracaso de la pirámide nutricional, las KD están recibiendo nuevamente la atención merecida.
En una serie de artículos se discutirá los beneficios y efectos de las KD, con el fin de esclarecer las dudas y prejuicios existentes.
¿Qué es una dieta cetogénica (KD)?
Las dietas cetogénicas se caracterizan por ser altas en grasas y bajas en carbohidratos, y aunque no existe consenso en el grado de restricción de carbohidratos, estos por lo general constituyen menos de 50g/día y en casos más extremos, menos de 20-30g/día. El bajo consumo de carbohidratos causa un estado metabólico conocido como cetosis (1). El "espacio" dejado por los carbohidratos puede ser reemplazando tanto como por proteínas o grasas, y no se restringe el consumo de calorías. Generalmente, el régimen se vuelve hipocalórico debido a la disminución de apetito y aumento de saciedad asociadas al alto consumo de proteínas y grasas (2).
Antes de la aplicación de la insulina para el tratamiento de la diabetes en los años 20, la terapia consistía en un cambio dietético para controlar la glicemia (3) y era muy diferente a las recomendaciones actuales (alta en carbohidratos y baja en grasa) (4). Por ejemplo, el Dr. Elliot Joslin, en 1923, formuló una dieta para diabéticos que consistía en "carnes, pollo, pescado, sopas claras, gelatina, huevos, aceite de oliva, mantequilla, café y té", conteniendo aproximadamente 5% de la energía a partir de carbohidratos, 20% a partir de proteína y 75% a partir de la grasa (5). Por esa misma época, Hugh Conklin descubrió que la epilepsia "resultaba por intoxicación del cerebro con sustancias provenientes del intestino" y propuso una "cura" con el ayuno, dándole solo agua a los pacientes por 20 días (6). Se descubrió que una dieta alta en grasas, con suficiente proteína y muy baja en carbohidratos simulaba este estado y se comenzó a utilizar con éxito (6). Desde entonces, se ha registrado beneficios usando este tipo de dietas para el tratamiento de enfermedades como Alzheimer (7), cáncer gástrico (8), cáncer cerebral (9, 10), inflamación y dolor crónico (11), esquizofrenia (12), esclerosis lateral amiotrófica (13), obesidad (14), diabetes mellitus tipo 2 (3), síndrome metabólico (aunque no es propiamente una enfermedad) (15), hígado graso no alcohólico (16), entre otras.
Entendiendo la cetosis
Las KD estimulan la producción de cuerpos cetónicos (CC): acetoacetato (AcAc), beta-hidroxibutirato (bHB) y acetona mediante la vía de 3-hidroxi-3-metilglutaril-CoA (HMG-CoA), en el hígado (17). Estos compuestos son liberados al torrente sanguíneo ya que el hígado no tiene las enzimas necesarias para usarlos como sustratos energéticos (17).
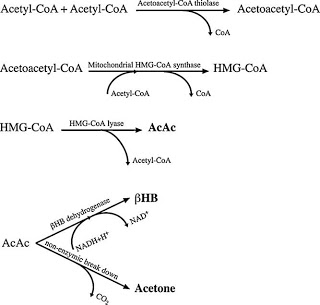
Por otro lado, la insulina disminuye la lipólisis y la liberación de FFA del tejido adiposo a la sangre (20), por lo que tiene un efecto negativo sobre la producción de CC. Cuando los niveles de insulina son bajos, se observa un cambio metabólico que produce una disminución de la degradación de amino ácidos para formar glucosa y sirve para preservar las reservas proteicas del cuerpo con gran eficiencia (21).
La cetosis suele asociarse al ayuno, por lo que la mayor cantidad de estudios se han basado en la cetosis inducida por este. Durante los primeros días del ayuno, los niveles de glucosa e insulina disminuyen a 65mg/100mL y 10-20microU/mL, respectivamente; mientras que los niveles de FFA se incrementan a 1.2 mEq/L (18). La habilidad para proveer sustratos a partir del tejido adiposo es facilitado aún más por la cetosis (22). El aumento de la concentración de CC (aproximadamente hasta 50mg/100mL) aumenta la utilización de CC por los tejidos y cerebro, disminuyendo las necesidades de glucosa, gluconeogénesis a partir de amino ácidos y la excreción de nitrógeno (18). De esta manera se produce un "ahorro" de las proteínas musculares y se disminuye el catabolismo proteico al reducir la dependencia de glucosa.
Si bien un ayuno completo por periodo prolongado puede causar la pérdida de masa magra, se puede lograr un estado similar al del ayuno manipulando la ingesta de macronutrientes. Se sabe que la estimulación de la insulina por los aminoácidos depende de los niveles de glucosa, siendo mayor cuando la glicemia se mantiene elevada (23). Es decir, cuando la glicemia es baja y la insulina también es baja, la estimulación de la insulina por parte de los amino ácidos es menor. Comparado con la misma cantidad de carbohidratos, la ingestión de proteína va a producir un aumento más leve en los niveles de insulina y va a haber una menor inhibición de la lipólisis. El consumo de 50 a 100g de carbohidratos por día (pero no de proteínas), reduce marcadamente la cetosis (18). Si se suprime el consumo de carbohidratos y se consume tan solo 0.6 - 1g/kg de proteína al día, se observa casi la misma cantidad de gluconeogénesis que durante el ayuno completo. La ingesta de proteínas compensaría la degradación de amino ácidos y el balance de nitrógeno llegaría a cero (18). Es así que en un estado de cetosis, y consumiendo solo proteína se lograría una reducción importante de peso principalmente de agua y tejido adiposo, a razón de 200-250g por día (18). Además, se ha demostrado que la respuestas metabólicas al ayuno no son por la restricción calórica per se sino a la restricción de glucosa (24). Entonces, podemos simular un estado de ayuno y obtener todos los beneficios de la cetosis restringiendo el consumo de glucosa, consumiendo una cantidad adecuada de proteína y grasas.
A pesar de que el principal sustrato durante la cetosis son los CC, siempre existe un grado de gluconeogénesis para proveer glucosa a aquellos tejidos que no pueden utilizar CC (glóbulos rojos, retina, lente ocular y médula renal) (25). Durante el ayuno, el principal sustrato para la gluconeogénesis es el lactato, y casi el 46% de la glucosa producida en el hígado proviene del reciclado del lactato y piruvato (56g/día). El glicerol proveniente del tejido adiposo proporciona unos 11g adicionales para formar glucosa (26) y se ha mostrado que la gluconeogénesis a partir de la alanina es de aproximadamente 10g/día (26). Finalmente, el hígado es capaz de formar 200g de glucosa por día en ausencia de carbohidratos (25).
Resumiendo
- La restricción de glucosa es la responsable del estado fisiológico observado durante el ayuno, conocido como cetosis.Referencias
- La utilización de CC por los tejidos es directamente proporcional a su concentración en plasma.
- La adaptación a un estado cetogénico va a disminuir los requerimientos de glucosa del cuerpo a solo 50g por día.
- El cambio desde un metabolismo dependiente de carbohidratos a uno dependiente de ácidos grasos y cuerpos cetónicos va a producir una disminución de la degradación proteica del músculo.
- El límite de carbohidratos necesarios para entrar en este estado es individual, aunque podría considerarse entre 50-100g/día.
- Los requerimientos de glucosa diarios pueden ser suministrados a partir de la proteína ingerida y del glicerol proveniente de la lipólisis de los triglicéridos del tejido adiposo y grasa de la dieta.
- La insulina es la principal hormona inhibidora de la lipólisis y oxidación de ácidos grasos, inhibiendo la producción de CC a partir de FFA. Los carbohidratos son los mayores estimuladores de la insulina.
- Una dieta con alta cantidad de grasas y proteínas, y muy baja cantidad de carbohidratos simula un estado de ayuno, sin los efectos negativos de un ayuno prolongado.
(1) Jeff S. Volek and Matthew J. Sharman. Cardiovascular and Hormonal Aspects of Very-Low-Carbohydrate Ketogenic Diets. Obes Res. 2004;12: 115S - 123S.
(2) Surender K Arora and Samy I McFarlane The case for low carbohydrate diets in diabetes management Nutrition & Metabolism 2005, 2:16
(3) William S Yancy Jr, Marjorie Foy, Allison M Chalecki, Mary C Vernon and Eric C Westman. A low-carbohydrate, ketogenic diet to treat type 2 diabetes. Nutrition & Metabolism 2005, 2:34
(4) Klein S, Sheard NF, Pi-Sunyer S, Daly A, Wylie-Rosett J, Kulkarni K, Clark NG: Weight management through lifestyle modification for the prevention and management of type 2 diabetes: rationale and strategies. A statement of the American Diabetes Association, the North American Association for the Study of Obesity, and the American Society for Clinical Nutrition. Am J Clin Nutr 2004, 80:257-263.
(5) Osler W, McCrae T: The Principles and Practice of Medicine. New York, Appleton and Co.; 1923.
(6) Freeman, J.M., Kelly, M.T., Freeman, J.B., 2002. The Ketogenic Diet: A Treatment for Epilepsy, 3rd ed. Demos Medical Publishers, New York.
(7) Richard D Feinman When is a high fat diet not a high fat diet? Nutrition & Metabolism 2005, 2:27
(8) Christoph Otto, Ulrike Kaemmerer, Bertram Illert, Bettina Muehling, Nadja Pfetzer, Rainer Wittig, Hans Ullrich Voelker, Arnulf Thiede and Johannes F Coy.Growth of human gastric cancer cells in nude mice is delayed by a ketogenic diet supplemented with omega-3 fatty acids and medium-chain triglycerides. BMC Cancer 2008, 8:122
(9) Seyfried et al. Targeting energy metabolism in brain cancer through calorie restriction and the ketogenic diet. J Can Res Ther- Supplement 1 2009- volume 5
(10) Weihua Zhou, Purna Mukherjee, Michael A Kiebish, William T Markis, John G Mantis and Thomas N Seyfried The calorically restricted ketogenic diet, an effective alternative therapy for malignant brain cancer Nutrition & Metabolism 2007, 4:5
(11) David N. Ruskin, Masahito Kawamura, Jr., Susan A. Masino. Reduced Pain and Inflammation in Juvenile and Adult Rats Fed a Ketogenic Diet PLoS ONE 4(12): e8349
(12) Bryan D Kraft and Eric C Westman. Schizophrenia, gluten, and low-carbohydrate, ketogenic diets: a
case report and review of the literature Nutrition & Metabolism 2009, 6:10
(13) Zhong Zhao, Dale J Lange, Andrei Voustianiouk, Donal MacGrogan, Lap Ho, Jason Suh, Nelson Humala, Meenakshisundaram Thiyagarajan, Jun Wang and Giulio M Pasinetti. A ketogenic diet as a potential novel therapeutic intervention in amyotrophic lateral sclerosis. BMC Neuroscience 2006, 7:29
(14) Frederick F. Samaha, M.D., Nayyar Iqbal, M.D., Prakash Seshadri, M.D., Kathryn L. Chicano, C.R.N.P., Denise A. Daily, R.D., Joyce McGrory, C.R.N.P., Terrence Williams, B.S., Monica Williams, B.S., Edward J. Gracely, Ph.D., and Linda Stern, M.D.A Low-Carbohydrate as Compared with a Low-Fat Diet in Severe Obesity n engl j med 348;21. 2003
(15) Jeff S Volek and Richard D Feinman. Carbohydrate restriction improves the features of Metabolic Syndrome. Metabolic Syndrome may be defined by the response to carbohydrate restriction. Nutrition & Metabolism 2005, 2:31
(16) David Tendler, Sauyu Lin, William S. Yancy Jr., John Mavropoulos, Pam Sylvestre, Don C. Rockey, Eric C.Westman. The Effect of a Low-Carbohydrate, Ketogenic Diet on Nonalcoholic Fatty Liver Disease: A Pilot Study. Dig Dis Sci (2007) 52:589 - 593
(17) Balietti et al. Ketogenic diets: An historical antiepileptic therapy with promising potentialities for the aging brain. Ageing Research Reviews 9 (2010) 273 - 279
(18) Jean-Pierre Flatt,Ph.D., and George L. Blackburn, M.D., Ph.D. The metabolic fuel regulatory system:
implications for protein-sparing therapies during caloric deprivation and disease. The American Journal of Clinical Nutrition 27: FEBRUARY 1974, pp. 175-187.
(19) BATES, M. W., H. A. KREBS AND D. H. WILLIAMSON. Turnover rates of ketone bodies in normal, starved and alloxan-diabetic rats. Biochem. J. 110: 655, 1968.
(20) Kathy Jaworski, Eszter Sarkadi-Nagy, Robin E. Duncan, Maryam Ahmadian and Hei Sook Sul Regulation of Triglyceride Metabolism.IV. Hormonal regulation of lipolysis in adipose tissue Am J Physiol Gastrointest Liver Physiol 293:1-4, 2007
(21) CAHILL, G. F., JR. Physiology of insulin in man. Diabetes 20: 785, 1971.
(22) KREBS, H. A., D. H. WILLIAMSON, M. W. BATES, M. A. PAGE AND R. A. HAWKINS. The role of ketone bodies in caloric homeostasis. Advan. Enzym. Regul. 9: 387, 1971.
(23) MULLER, W. A., G. R. FALOONA AND R. H. UNGER. The influence of the antecedent diet upon glucagon and insulin secretion. New Engl. J. Med. 285: 1450, 1971.
(24) Klein S, Wolfe RR. Carbohydrate restriction regulates the adaptive response to fasting. Am J Physiol. 1992 May;262(5 Pt 1):E631-6.
(25) Eric C Westman, Richard D Feinman, John C Mavropoulos, Mary C Vernon, Jeff S Volek, James A Wortman, William S Yancy, and Stephen D Phinney. Low-carbohydrate nutrition and metabolism. Am J Clin Nutr 2007;86:276 - 84.
(26) A. J. Garber, P. H. Menzel, G. Boden, and O. E. Owen. Hepatic Ketogenesis and Gluconeogenesis in Humans. The Journal of Clinical Investigation Volume 54 October 1974 981-989




Comentario: la dieta cetogénica constituye una auténtica senda para la transformación de nuestro cuerpo y nuestra mente. Para el lector interesado, SOTT recomienda fuertemente la lectura en el foro cassiopaea.org del hilo Dieta Cetogénica: camino hacia la transformación, donde podrá conocer y aprender de la experiencia de quienes han experimentado con esta extraordinaria "forma de alimentarse".