Comentario: No se pierdan esta serie sobre el gluten, el veneno de nuestra sociedad, que la Ciencia oficial se niega a explicarnos. Por tu salud y la de tus seres queridos, INFÓRMATE sobre los problemas de consumir gluten. Esta información es muy importante para los veganos que han sido engañados para creer que han encontrado la dieta definitiva.
El gluten está compuesto por dos grupos de proteínas principales, gluteninas y gliadinas, ambas asociadas al desarrollo de enfermedad celíaca (EC) y patologías autoinmunes. Briani et al (1) han resumido elegantemente la fisiopatología de la EC y respuesta inmune hacia el gluten:
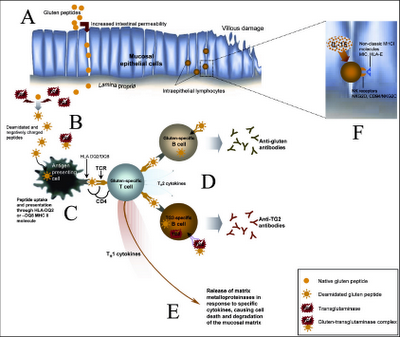
A. Los péptidos producidos durante la degradación parcial del gluten cruzan la barrera intestinal, produciendo un incremento en la permeabilidad intestinal.
B. Los péptidos de gluten relevantes (a la respuesta inmune) son deamidados por la TG2 (transglutaminasa), creando epítopes (parte del antígeno reconocido por el sistema inmune) con potencial inmunoestimulante elevado. Estos péptidos también se pueden unir covalentemente a TG2 u otras proteínas mediante la actividad enzimática de TG2.
C. Los péptidos deamidados son presentados por las células presentadoras de antígenos, como células dendríticas, macrófagos o células B, a las células T CD4+.
D. Las células T específicas de gluten producen una expansión clonal de las células B y liberación de anticuerpos contra el gluten. Las células B específicas de TG2 también pueden activarse por las células T específicas de gluten, mediante ayuda intermolecular.
E. La expresión de citoquinas pro-inflamatorias por las células T activadas promueve la liberación de metaloproteinasas de matriz que causan daño epitelial y remodelación tisular.
F. La respuesta al gluten también involucra al sistema inmune innato, ya que las células epiteliales secretan IL-15 y expresan moléculas MHC-1 no clásicas en respuesta a la exposición al gluten, lo que activa las células T CD8+ citotóxicas que expresan receptores para Natural Killer, las cuales pueden reconocer y destruir las células epiteliales que contienen las moléculas inducidas por el estrés.
Pero la pregunta, fuera de los mecanismos desencadenados una vez que ya se produce el proceso autoinmune, es ¿Cómo el gluten desencadena la presentación antigénica de proteínas propias? Esto corresponde a los puntos A, B, C y D del esquema anterior.
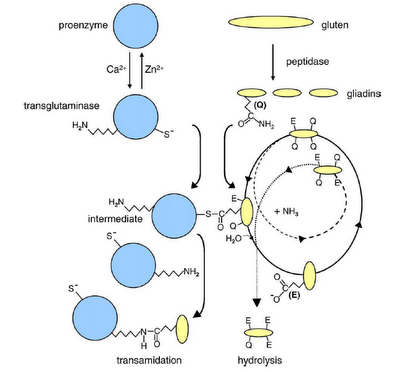
Todo empieza con la digestión parcial del gluten a péptidos que atraviesan el borde de cepillo intestinal e interactúan con TG2. La TG2 es una enzima que cataliza el entrecruzamiento de proteínas por la formación de un enlace peptídico entre un residuo de glutamina y lisina; así como la deamidación y conversión de residuos de glutamina (carga neutra) a glutamato (carga negativa). La gliadina es uno de los sustratos preferidos por esta enzima. La reacción entre la TG2 y la gliadina se ilustra a continuación (2):
La TG2 es activada por el calcio e inactivada por el zinc. Los residuos de glutamina (Q) presente en zonas ricas en prolina de las moléculas de gliadina sirven de sustratos para la enzima. Se forma un tioéster como intermediario de Michaelis-Menten. En ausencia de una amina primaria o a un pH bajo, el agua sirve como segundo sustrato. El ciclo se repite, dando moléculas de gliadina con residuos de ácido glutámico (E) en posiciones específicas. En esta hidrólisis, el segundo paso es el paso limitante, dando como resultado una acumulación del intermediario tioéster. En la figura, la transamidación está ilustrada como una reacción atípica cuando un residuo de lisina de TG2, en ausencia de un sustrato amino adecuado, ataca nucleofílicamente el intermediario tioéster, produciendo un complejo entre TG2 y la gliadina.
Resumiendo, la interacción de TG2 con la gliadina puede dar como resultado dos productos: el intermediario tioéster y el producto de la transamidación (última molécula de la izquierda). Debido a que la etapa limitante de la reacción completa hasta el complejo TG2-gliadina es la transaminación, el nivel del intermediario tioéster suele ser alto.
Cada cepa de trigo contiene genes que codifican más de 50 y hasta 150 diferentes gliadinas clasificadas como α/β, γ y ώ, basadas en su movilidad electroforética y secuencia de aminoácidos. Esto ocasiona un problema a la hora de encontrar epítopes y regiones específicas de reconocimiento por las células T. Sin embargo, a pesar de no conocer la secuencia total, existen algunos epítopes caracterizados, como por ejemplo:
- (141)QPQQSFPEQQ(150), γ-gliadina, restringido a DQ2
- (206)SGQGSFQPSQQ(216), α-gliadina, restringido a DQ8
- (724)QGYYPTSPQQS(734), glutenina, restringido a DQ8
Se ve más complicado de lo que es. Los números entre paréntesis indican la posición del péptido en donde comienza el epítope (en el primero, comienza en el residuo 141, Q; y termina en el residuo 150, Q). Las letras indican los aminoácidos que conforman el péptido (se utiliza la abreviación de una letra para cada aminoácido). Estos péptidos se han encontrado en diferentes tipos de gliadinas y gluteninas (en el primero, la variación γ de la gliadina). El término "restringido" hace referencia a qué tipo de receptor reconoce la secuencia (DQ2 ó DQ8). Los HLA-DQ son un tipo de receptor que se encuentra en las células presentadoras de antígenos. Los diferentes tipos de isoformas (ej. DQ2) se pueden unir y presentar diferentes antígenos a las células T, estimulando la producción de anticuerpos por las células B. Parece existir un consenso, basado en la cinética enzimática de la reacción, en que el intermediario tioéster es el neo-antígeno reconocido por las células T.
De esta manera, se reconoce a la TG2 como neo-antígeno mediado por el reconocimiento de un antígeno exógeno (gliadina).
Referencias
Stenberg P, Roth B, Wollheim FA. Peptidylarginine deiminases and the pathogenesis of rheumatoid arthritis: a reflection of the involvement of transglutaminase in coeliac disease. Eur J Intern Med 2009 Dec;20(8):749-55
Briani C, Samaroo D, Alaedini A. Celiac disease: from gluten to autoimmunity. Autoimmun Rev 2008 Sep;7(8):644-50
K. E.A. Lundin. Coeliac disease - all questions answered? Digest Liver Dis 2002;34:238-42
Stenberg P, Roth B, Sjöberg K. Transglutaminase and the pathogenesis of coeliac disease. Eur J Intern Med 19 (2008) 83 - 91




Comentario: Más información:
El glúten ataca el cerebro y daña el sistema nervioso
Conozca los datos sobre la sensibilidad al gluten
Intolerancia al gluten y caseina relacionada con el autismo, hiperactividad y otros transtornos del comportamiento
Aprende a comer de una forma saludable, sin gluten:
La dieta paleolítica no es un régimen para adelgazar sino un estilo de vida
La dieta cetogénica - Una visión general
Dieta cetogénica I y Dieta cetogénica II