© Desconocido
Los salones académicos se están llenando de una nueva especie de científico de reciente aparición,
el psiconeuroinmunologo, que se gana la vida estudiando un hecho extraordinario: de qué modo lo que nos pasa por la cabeza puede influir en el funcionamiento del sistema inmunitario. Se creía que ambos campos se hallaban totalmente separados: el sistema inmunitario destruye las bacterias, crea anticuerpos, busca tumores; el cerebro crea poesía, inventa la rueda y tiene programas preferidos de televisión. Pero el dogma de la separación de los sistemas nervioso e inmunitario se ha hundido por la base. Desde el sistema nervioso autónomo llegan nervios a los tejidos que forman o almacenan las células del sistema inmunitario que acaban en la circulación sanguínea. Además, resulta que el tejido del sistema inmunitario es sensible a todas las hormonas importantes que segrega la pituitaria bajo control del cerebro, es decir, posee receptores de ellas, lo que se traduce en un
enorme potencial del cerebro para meter las narices en asuntos del sistema inmunitario.
Las pruebas de que el cerebro influye en el sistema inmunitario se remontan por lo menos a un siglo atrás, cuando se demostró que una rosa artificial desencadenaba una respuesta alérgica en un paciente alérgico a las rosas (y que ignoraba que fuera falsa). He aquí una demostración encantadora y mas reciente de la influencia del cerebro sobre el sistema inmunitario: escojamos a varios actores profesionales y hagámosles pasar un día entero representando o bien una escena emocionalmente depresiva o una que levante el animo a niveles de euforia. Los del primer estado muestran una menor sensibilidad inmune, mientras que los del último manifiestan un incremento. (¿Y donde se llevo a cabo semejante estudio? En los Ángeles, por supuesto, en UCLA.)Pero el estudio que ha demostrado de forma más convincente la relación entre el cerebro y el sistema inmunitario utilizo un paradigma denominado "inmunosupresión condicionada".
Se administra a un animal una droga que suprime su sistema inmunitario. Al mismo tiempo que se le proporciona, a la manera de los experimentos de Pavlov, un "estimulo condicionado"; por ejemplo, una bebida con aroma artificial, algo que el animal asocie con la droga supresora. Días después se presenta al animal solo el estimulo condicionado..., y la función inmunitaria disminuye. En 1982, los científicos se quedaron asombrados ante el informe de un experimento en que se empleaba una variante de este paradigma y que había sido llevado a cabo por dos pioneros en este campo: Robert Ader y Nicholas Cohen. Experimentaron con una especie de ratones que desarrollan enfermedades de forma espontanea, a causa del exceso de actividad de su sistema inmunitario. Normalmente, la enfermedad se controla administrando a los ratones una droga inmunodepresora. Ader y Cohen demostraron que, empleando sus técnicas de condicionamiento podían sustituir la droga por el estimulo condicionado y modificar el sistema inmunitario de los animales lo suficiente como para alargarles la vida.
© Desconocido
Este tipo de estudio convenció a los científicos de la existencia de una estrecha relación entre el sistema nervioso y el inmunitario.
No es de extrañar que si la visión de una rosa artificial o el sabor artificial de una bebida alteran la función inmunitaria también lo haga el estrés. En la primera mitad de este capitulo voy a referirme al modo en que el estrés tiende a suprimir la función inmunitaria y a las razones por las que sería útil eliminarla ante una emergencia estresante. En la segunda mitad examinaremos si el estrés prolongado, mediante la supresión crónica del sistema inmunitario, puede deteriorar la capacidad del cuerpo de luchar contra las infecciones. Se trata de un interrogante fascinante, al que solo se puede responder con mucha prudencia y muchas precauciones. Aunque
están apreciando pruebas de que la inmunosupresión inducida por estrés aumenta el riesgo y la gravedad de las enfermedades, la conexión es probablemente bastante débil y su importancia se suele exagerar.
Para evaluar los resultados de este campo confuso pero importante, tenemos que empezar por unas nociones elementales sobre el funcionamiento del sistema inmunitario.
Nociones básicas sobre el sistema inmunitario.La labor principal del sistema inmunitario consiste en defender el cuerpo de agentes infecciosos como los virus, las bacterias, los hongos y los parásitos. Se trata de un proceso enormemente complejo. En primer lugar, el sistema inmunitario tiene que saber distinguir entre las células normales que forman parte del cuerpo y las invasoras; en la jerga inmunológica se habla de diferenciar ente el "yo" y el" no yo". De algún modo, el sistema inmunitario recuerda el aspecto de cada célula del organismo y ataca a cualquier otra ( por ejemplo, una bacteria) que carezca del sello celular distintivo: Además, cuando el sistema inmunitario se topa con un nuevo invasor, crea un recuerdo inmunológico de cómo es el agente infeccioso, para estar mejor preparado para la siguiente invasión, proceso en el que se basa la vacunación con una versión rebajada del agente infeccioso a fin de preparar el sistema inmunitario para un ataque real.
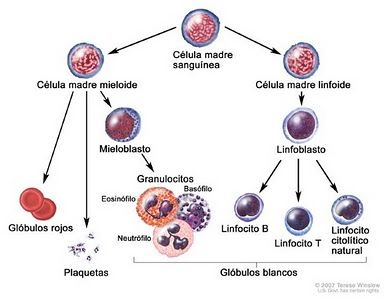
Las defensas inmunitarias son producidas por un complejo conjunto de células de la corriente sanguínea llamadas linfocitos y monocitos (que reciben el nombre colectivo de glóbulos blancos; cito significa célula). Hay dos clases de linfocitos; las células T y las células B. Ambas se originan en la medula ósea, pero las T emigran al timo para madurar ( por eso se llaman" T"), mientras que la B maduran en la medula. Las B fundamentalmente producen anticuerpos, pero hay varios tipos de células T( células T auxiliares y células T supresores, células agresoras citotoxicas, etcétera).
Las células T y B atacan a los agentes infecciosos de forma muy distinta. Las T producen inmunidad mediada por células. Cuando un agente infeccioso invade el organismo, es reconocido por un tipo de monocito llamado macrófago, que da a conocer la partícula extraña a una célula T auxiliar. Suena una alarma metafórica y las células T comienzan a proliferar en respuesta a la invasión. Este sistema de alarma se traduce en la activación y proliferación de un tipo de monocito llamado macrófago sale al encuentro de un agente infeccioso,(2) El macrófago presenta el agente infeccioso a una celula auxiliar T ( un tipo de glóbulo blanco) y segrega interleuquina 1 (IL-1) que estimula la actividad de las células auxiliares T (3) a consecuencia de ello, la celula auxiliar T libera interleuquina 2(IL2) que desencadena la proliferación de las células T (4) esto origina la proliferación de otro tipo de globulos blancos, las células agresoras citotoxicas, que destruyen el agente infeccioso células agresoras citotoxicas, que, como su nombre indica, atacan al agente infeccioso y lo destruyen.(A título informativo, el componente celular T del sistema inmunitario es el que destruye el virus del sida).
Las células B, por el contrario, producen inmunidad mediada por anticuerpos. Cuando la unión de macrófagos y células T auxiliares hacen sonar la campana, estas también estimulan la proliferación de células B. La tarea principal de estas células consisten en diferenciar y generar anticuerpos, grandes proteínas que reconocen un rasgo especifico del agente infeccioso invasor y se ligan a él (generalmente, una proteína superficial distintiva). Esta especificidad es fundamental; el anticuerpo formado tiene una forma única, que se adapta perfectamente a la del rasgo distintivo del invasor, como si fueran una llave y su cerradura. Al ligarse a rasgos específicos, los anticuerpos inmovilizan los agentes infecciosos y los destruyen.
El sistema inmunitario posee otro rasgo complejo. Cuando distintas partes del hígado, por ejemplo, tienen que coordinar determinada actividad poseen la ventaja de estar unas al lado de otras. Pero el sistema inmunitario se halla distribuido por la circulación sanguínea. Para hacer sonar la alarma en todo el sistema, tiene que haber mensajeros químicos en la sangre que comuniquen entre si los distintos tipos de células. Por ejemplo, cuando los macrófagos reconocen por primera vez un agente infeccioso, segregan un mensajero denominado interleuquina, que hace que las células T auxiliares liberen interleuquina, que estimula el crecimiento de las células T (para complicar las cosas, hay otras seis interleuquinas, con funciones mas especializadas). En el frente de los anticuerpos las células T también segregan un factor de crecimiento de las células B. Otras clases de mensajeros, como los interferones, activan tipos más amplios de linfocitos.
El proceso de selección entre el yo y el no yo que realiza el sistema inmunitario suele funcionar bien ( aunque hay parásitos tropicales realmente insidiosos, como los que causan esquistosomiasis, que han evolucionado para que el sistema inmune no los detecte, " pirateando" el sello de las células del organismo al que atacan). El sistema inmunitario para el tiempo alegremente distinguiendo el yo del no yo: "glóbulos rojos, míos; cejas, de mi lado; virus, no son buenos; hay que atacar; células musculares, buenas chicas..."
© Desconocido
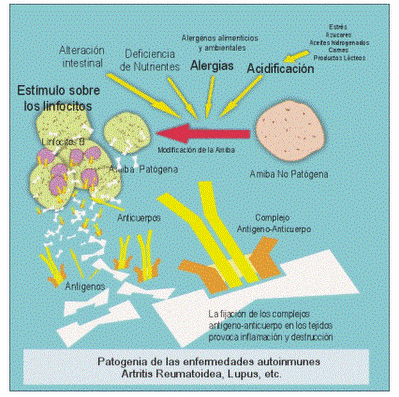
¿Qué pasa si algo va mal en la selección? Un tipo de error obvio podría ser que el sistema inmunitario no detectara a un agente infeccioso invasor: mal asunto. Igual de grave seria el error opuesto: que el sistema inmunitario confundiera una parte normal del organismo con un agente infeccioso y lo atacara. En una variante de esto, algún compuesto absolutamente inofensivo que existe en nuestro entorno activa una reacción de alarma. Tal vez sea algo que uno ingiere normalmente, como cacahuetes o marisco, o algo aerotransportado e inocuo, como el polen. Pero
nuestro sistema inmune decide de forma errónea que no solo es un elemento extraño sino peligroso, y activa el mecanismo de defensa. Esto es una alergia.En la segunda variante de la reacción excesiva del sistema inmunitario el supuesto peligro está en el propio organismo. Cuando el sistema inmunitario ataca por error una parte normal del cuerpo (auto inmunización), puede producirse diversas enfermedades autoinmunes espantosas. En la esclerosis múltiple, por ejemplo, se ataca parte del sistema nervioso; en la diabetes juvenil, las células del páncreas que normalmente segregan insulina. Como vamos a ver,
el estrés tiene efectos confusos en las enfermedades autoinmunes.Hasta ahora en este examen general del sistema inmunitario, nos hemos concentrado en algo llamado inmunidad adquirida. Supongamos que somos expuestos por primera vez a algún nuevo y peligroso patógeno, el patógeno X. La inmunidad adquirida posee tres características. Primera, adquirimos la capacidad de atacar el patógeno en particular con anticuerpos e inmunidad mediada por células que lo reconocen de forma específica. Esto realmente actúa en nuestro beneficio. Segunda se tarda un tiempo en crear esa inmunidad cuando uno se expone por primera vez al patógeno X esto implica encontrar que anticuerpo es el más apropiado y generar millones de copias suyas. Por último, aunque ya nos hayamos pertrechado para perseguir de forma específica al patógeno durante mucho tiempo, una vez que esa defensa concreta esta lista, la exposición repetida al patógeno aumentara aun mas esas defensas.
Semejante inmunidad adquirida es una invención bastante sofisticada, y solo existe en los vertebrados. Pero también poseemos una rama más sencilla y más antigua del sistema inmunitario, compartida con especies tan distantes como los insectos, que se llama inmunidad innata. En este ámbito no nos molestamos en adquirir los medios para destruir al patógeno X con anticuerpos diferentes de los que emplearíamos contra, digamos el patógeno Y. Cualquiera que sea la segunda clase de patógeno que ataque nuestro sistema, esta respuesta inmune no especifica entrara en acción.
Dicha respuesta inmune generalizada tiende a producirse en la cabeza de playa donde el patógeno conquista su primera posición, ya sea en nuestra piel, o en un tejido húmedo mucoso, como la boca o la nariz. En un primer paso, nuestra saliva contiene una clase de anticuerpos que generalmente atacan a todos los microbios que encuentran, en lugar de adquirir los medios para destruir a invasores específicos. Estos anticuerpos, una vez segregados, cubren las superficies mucosas como una pintura antiséptica. Por otra parte, en el lugar de la infección, los capilares se aflojan, permitiendo que las células de la respuesta inmune innata se salgan de la circulación para inflitarse en la zona adyacente a la infección. Entre estas células se hallan macrófagos, neutrofilos y células agresoras naturales, que luego atacan al microbio. El aflojamiento de los capilares también permite flujos que contienen proteínas que pueden combatir a los microbios invasores para que fluyan en la circulación. ¿Y cuál es el resultado de todo esto? Las proteínas luchan contra el microbio, pero el fluido también hace que la zona se hinche, causando edema. He aquí a nuestro sistema inmunitario innato entrando en acción y causando inflamación.
Esto nos da una amplia visión general de la función inmune. Es hora de ver que hace el estrés con la inmunidad. Naturalmente, como se verá, muchas cosas mas complicadas de las que cabria esperar.
¿Cómo inhibe el estrés la función inmunitaria?Hace casi setenta años que Selye descubrió las primeras pruebas de la inmunosupresión inducida por estrés y observó que en las ratas sometidas a molestias no especificas se atrofian los tejidos inmunes, como la glándula del timo. Desde entonces, los científicos han aprendido mas cosas sobre las sutilizas del sistema inmunitario, y resulta que un periodo de estrés altera un amplio conjunto de funciones inmunitarias: la formación de nuevos linfocitos y su secreción a la corriente sanguínea, la creación de nuevos anticuerpos como respuesta a un agente infeccioso y la comunicación entre los linfocitos mediante la liberación de mensajeros relevantes, por citar algunas. E inhibe la respuesta del sistema inmunitario, suprimiendo la inflamación. Toda clase de agentes estresantes--- físicos, psicológicos--- hacen esto en primates, ratas, aves, incluso en los peces. Y, por supuesto también en los humanos.
La forma mejor documentada en que tiene lugar esta supresión del sistema es a través de los glucocorticoides, que, por ejemplo, provocan la reducción de la glándula del timo; este efecto es tan seguro que antaño, antes de que fuera posible medir de forma fácil y directa la cantidad de glucocorticoides en la sangre, una forma indirecta de hacerlo consistía en comprobar el grado de disminución de la glándula timo en un animal; cuanto menor fuera, mas glucocorticoides había en el torrente circulatorio. Los glucocorticoides detiene la formación de nuevos linfocitos en el timo; la mayor parte del tejido de esta glándula está formado por esas células, listas para ser liberadas a la sangre. Debido a que los glucocorticoides inhiben la secreción de mensajeros como las interleuquinas y los interferones, hacen asimismo que disminuya la sensibilidad de los linfocitos a la alarma de infección. Además expulsan a los linfocitos de la corriente sanguínea. La mayor parte de estos efectos de los glucocorticoides van dirigidos contra las células T, en lugar de las B, lo que significa que la inmunidad mediada por las células se ve más alterada que la inmunidad mediada por anticuerpos. Y lo que es aun más impresionante es que los glucocorticoides pueden destruir a los linfocitos, lo cual nos introduce en uno de los temas más controvertidos de la medicina: la "muerte celular programada". Las células están programadas para suicidarse en determinadas ocasiones. Por ejemplo si una célula comienza a volverse cancerosa, hay una vía de suicidio que se activa para matar a la célula antes de que empiece a dividirse fuera de control; algunos tipos de cáncer implican el fallo de la muerte celular programada. Y los glucocorticoides pueden provocar el suicidio de los linfocitos por medio de diverso mecanismos.
Las hormonas del sistema nervioso simpático o betaendorfinas también desempeñan un papel en la supresión de la inmunidad durante el estrés. Aunque los mecanismos precisos siguen siendo tan poco claros para los científicos como la supresión inmunitaria inducida por los glucocorticoides. No obstante, diversos experimentos han demostrado que los agentes estresantes pueden suprimir la inmunidad con independencia de la secreción de glucocorticoides, lo que claramente señala estas otras rutas.
¿Por qué se suprime la inmunidad durante el estrés?Averiguar de que forma exacta los glucocorticoides y las otras hormonas del estrés suprimen la inmunidad es un tema muy controvertido en la biología celular y molecular de la actualidad, en especial la parte relacionada con la eliminación de los linfocitos. Pero en medio de todo este alboroto sobre la ciencia de vanguardia, sería razonable comenzar a preguntarse por que tiene que producirse la supresión del sistema inmune durante el estrés. Porque es lógico, desde el punto de vista adaptativo, eliminar la inmunidad durante el estrés.
Durante el estrés es lógico que el organismo detenga los proyectos de construcción a largo plazo para canalizar la energía hacia las necesidades inmediatas; en esta inhibición se incluye el sistema inmunitario, que, aunque maravilloso a la hora de detectar un tumos que nos causaría la muerte en seis meses o la de crear anticuerpos que nos ayudan en el plazo de una semana, no es vital en una emergencia. Tal explicación tendría sentido si el estrés congelara el sistema inmunitario tal como se halla cuando se presenta la emergencia y no se produjeran más gastos inmunitarios hasta que esta hubiera terminado. Pero no es esto lo que sucede, sino que el estrés desmonta activamente el sistema; atrofia los tejidos y destruye las células, lo cual no se explica mediante un simple cese de los gastos, así que vamos a hacer un paréntesis para examinar las teorías del largo plazo y del corto plazo.
¿Por qué la evolución nos ha obligado a hacer algo tan aparentemente estúpido como desmontar el sistema inmunitario durante el estrés? Tal vez no haya una buena razón. En realidad, esta no es una respuesta tan absurda como parece. No todo en el cuerpo tiene que tener una explicación en términos de adaptación evolutiva. Quizá la inmunosupresión inducida por estrés es simplemente una consecuencia de otra cosa que es adaptativa.
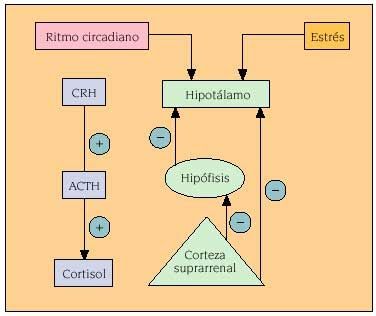
En este caso, es poco probable. Durante una infección, el sistema inmunitario libera un transmisor químico, la interleuquina, que entre otras cosas, estimula la liberación de CRH por parte del hipotálamo. El CRH estimula la pituitaria para que libere ACTH, que, a su vez, hace que las glándulas suprarrenales segreguen glucocorticoides que suprimen la actividad inmunitaria. Es decir, en determinadas circunstancias el sistema inmune pide al cuerpo que segreguen hormonas que, en último término, lo suprimen. Sea cual sea la razón, el caso es que se produce la inmunosupresión, a veces promovida por el propio sistema inmunitario. Probablemente no se trate de un accidente.
Varias ideas han circulado, durante años para explicar porque desmontamos de forma activa la inmunidad durante el estrés con la voluntaria cooperación del sistema inmunitario. Algunas parecían bastante verosímiles hasta que aprendimos un poco más sobre inmunidad y pudimos deshacernos de ellas. Otras eran bastantes tontas. Pero en la última década, ha aparecido una respuesta, y realmente pone todo este campo patas arriba.
SorpresaResulta que durante los primeros minutos (digamos que hasta unos treinta) posteriores a la aparición de un agente estresante, la inmunidad no se suprime de manera uniforme, se refuerzan muchos aspectos de esta. ( fase A en la ilustración nº 3) Sucede en todos los ámbitos de la inmunidad, pero en particular en la inmunidad innata. Esto tiene sentido; puede ser útil las partes de nuestro sistema inmune que producirán algunos anticuerpos para nosotros a lo largo de las próximas semanas, pero tiene incluso mas sentido activar inmediatamente las partes del sistema inmune que nos van ayudar ahora mismo. Mas células inmunes son liberadas al torrente circulatorio y, en el sistema nervioso dañado, mas células inflamatorias se infiltran en el lugar de la herida. Además los linfocitos en circulación son mejores liberando y respondiendo a esos transmisores inmunes. Y más cantidad de esos anticuerpos genéricos del sistema inmune innato son liberados a nuestra saliva. Este aumento de la inmunidad no sucede únicamente después de algún reto infeccioso. Los agentes estresantes físicos y psicológicos parecen ser la causa de una temprana activación inmune. Y lo que es aun mas asombroso, esos villanos inmunosupresores, los glucocorticoides, parecen desempeñar un importante papel en esto (junto con el sistema nervioso simpático).
De modo que con la aparición de toda clase de agentes estresantes, nuestras defensas, inmunes se refuerzan. Y ahora estamos listos para la otra parte de esta espada doble filo, cuando el estrés se prolonga por más tiempo. Al cabo de una hora, la permanencia de los glucocorticoides y de la activación del simpático comienza a tener el efecto opuesto, a saber, la supresión de la inmunidad. Si el agente estresante desaparece entonces, ¿que hemos conseguido con esa inmunosupresión? Llevar la función inmune de nuevo a su lugar de partida. (a la línea de base (fase B)) Únicamente con los grandes agentes estresantes de larga duración, o con una exposición a los glucocorticoides realmente considerable, es cuando el sistema inmune no solo regresa a la línea dé base, sino que cae en picado hacia la inmunosupresión. ( fase C). Respecto a la mayoría de las cosas que se pueden medir en el sistema inmune, los agentes estresantes sostenidos bajan los números hasta un 40 a 70 por 100 por debajo de la línea de base
© Desconocido
Que nuestro sistema inmune se refuerce temporalmente con la aparición de unos agentes estresantes tiene bastante sentido ( desde luego no menos que algunas retorcidas teorías acerca de por que suprimirlo tiene sentido). Como la idea de que todo lo que sube tiende a bajar, es decir que si un agente estresante se mantiene demasiado tiempo, se puede producir una caída adaptativa de nuevo a la línea de base y crearnos problemas.
¿Porque se ha tardado tanto tiempo en averiguar esto? Probablemente por dos razones. Primera, porque muchas de las técnicas que se emplean para medir lo que ocurre en el sistema inmune hace poco que han alcanzado el suficiente grado de sensibilidad como para detectar mínimas diferencias. Así, durante décadas, los investigadores creían estar estudiando la respuesta inmune al estrés. Como segunda razón, la mayoría de los científicos de este campo estudian agentes estresantes importantes y prolongados, o administran grandes cantidades de glucocorticoides durante largos periodos. Esto representa una tendencia razonable en la forma de realizar experimentos. Si no ocurre nada, eliges un nuevo campo que estudiar. Si ocurre algo y se ha replicado tantas veces que puedes confiar en los resultados, solo entonces empiezas a pensar en elaboraciones más sutiles. Así que en los primeros años, los investigadores solo estudiaban la clase de agentes estresantes o pautas de exposición a los glucocorticoides.
Esta reorientación del campo representa un triunfo para Allan Munck y sus colaboradores del Darmouth School, quienes no solo predijeron la mayoría de estos avances, sino también lo que resulta ser la respuesta a una pregunta que surge al cabo de un tiempo ¿Por qué no tener un ejército que nos defiende en máxima alerta siempre?. Por una razón, es demasiado caro. Y lo que es más importante, un sistema que está en estado de máxima alerta es mas probable que desmande en algún momento y dispare a uno de los nuestros en un accidente de fuego amigo. Y esto es lo que puede suceder con los sistemas inmunes que se activan de forma crónica: empiezan a confundir parte de uno con algún elemento invasor, y entonces acabamos desarrollando una enfermedad autoinmune.
Esta idea se ha verificado en al menos tres ámbitos. Primero, bloquear de modo artificial los niveles de glucocorticoides en un espectro basal bajo de diversas ratas y luego estresarlas. Esto produce animales que tienen fase A (en su mayoría mediadas por la adrenalina), pero no se produce la subida de glucocorticoides que daría paso a la fase B. Las ratas ahora corren mayor riesgo de enfermedad autoinmune. Segundo, los médicos a veces tienen que extirpar una de las dos glándulas renales ( la fuente de glucocorticoides) de un paciente normalmente debido a un tumor. Inmediatamente después, los niveles de glucocorticoides en circulación descienden a la mitad durante un tiempo, hasta que la glándula restante logra hacer el trabajo de la dos. Durante ese periodo de bajo nivel de glucocorticoides, hay mas, probabilidades de lo normal de que las personas desarrollen alguna enfermedad autoinmune o inflamatoria. Por último, si examinamos conjuntos de ratas o pollos que desarrollan de forma espontanea enfermedades autoinmunes, resulta que todas tienen algo que no marcha bien en su sistema glucocorticoideo por lo que poseen niveles de la hormona más bajos de lo normal, o células inmunes e inflamatorias menos sensibles a los glucocorticoides de lo normal. Lo mismo ocurre con los humanos con enfermedades autoinmunes como la artritis reumatoide. Por tanto, al comienzo de esta respuesta de estrés, se activa el sistema inmune, y una gran cosa que hace la respuesta de estrés es asegurarse de que la activación inmune no suba hasta la autoinmunidad. Todo esto ha obligado a ciertos replanteamientos en este campo. Una vez que el estrés ha durado lo suficiente como para empezar a suprimir la inmunidad, algunos de los aspectos que tradicionalmente se atribuían a la supresión de la inmunidad en realidad son versiones más sutiles de un reforzamiento inmune.
Esto se ve de dos maneras. Si administramos a alguien cantidades masivas de glucocorticoides, o lo sometemos a un inmenso agente estresante que dure muchas horas, las hormonas se pondrán a matar linfocitos de forma indiscriminada. Si tenemos una leve subida en los niveles de los glucocorticoides durante un corto periodo de tiempo, las hormonas mataran solo aun subgrupo particular de linfocitos; los más viejos y los que no funcionan. En esa fase los glucocorticoides esta ayudando a esculpir la respuesta inmune deshaciéndose de los linfocitos que no son ideales para la urgencia inmediata. Esto equivale de forma indirecta a una versión del reforzamiento inmune.
Los glucocorticoides no solo matan linfocitos, también expulsan del sistema circulatorio a los linfocitos que quedan. Firdhaus Dhabhar, de la universidad del estado de Ohio, se preguntaba; ¿Adonde van esas células inmunes cuando se las pone fuera de circulación? Siempre se ha creído que irían a tejidos de almacenamiento inmune (como la glándula de timo), pero el trabajo de Dhabhar muestra que no es así, sino que los glucocorticoides y la adrenalina envían a muchos de estos linfocitos al lugar de la infección, como la piel. No se desactivan las células inmunes, sino que son trasladadas a las líneas del frente. Una consecuencia de esto es que la herida se cura antes.
Estos nuevos hallazgos ayudan a explicar una de las paradojas más persistentes de este campo, referida a las enfermedades autoinmunes. Dos hechos sobre la autoinmunidad:
1. En la medida en que las enfermedades autoinmunes conllevan una activación excesiva del sistema inmune (hasta el punto de considerar una parte sana de nuestro cuerpo como un elemento invasor), el tratamiento más eficaz para dichas enfermedades es poner a la gente "en esteroides"; administrarles cantidades masivas de glucocorticoides. La lógica aquí es evidente: al suprimir radicalmente el sistema inmune, esta ya no puede atacar nuestro páncreas o sistema nervioso ( y, como obvio efecto colateral, nuestro sistema inmune no será muy eficaz en la defensa frente a patógenos verdaderos). Por tanto administrar grandes cantidades de estas hormonas de estrés hace que las enfermedades autoinmunes sean menos perjudiciales. Además, los agentes estresantes prolongados disminuyen los síntomas de las enfermedades autoinmunes.
2. Al mismo tiempo, parece que el estrés puede agravar las enfermedades autoinmunes. Esto a menudo ha sido confirmado por los pacientes y es abiertamente pasado por alto por los médicos clínicos que saben que las hormonas de estrés ayudan a reducir la autoinmunidad, no a empeorarla. Pero algunos estudios objetivos también apoyan esta idea en lo que respecta a enfermedades autoinmunes como la esclerosis múltiple, la artritis reumatoide, la enfermedad de Grave, la colitis ulcerosa, la inflamación intestinal y el asma.
Como cabria esperar, si tenemos agentes estresantes masivos, o se nos administran elevadas dosis de glucocorticoides, ponemos el sistema en drástica supresión inmune, lo que disminuye los síntomas de autoinmunidad. Este resumen lo apoya el descubrimiento de que mientras el estrés agudo pone a las ratas en mayor riesgo de padecer una esclerosis múltiple, el estrés crónico suprime los síntomas de esa enfermedad autoinmune. Al parecer, el sistema no evoluciono para tratar con numerosas repeticiones en las que se coordinasen las diversas activaciones y desactivaciones, y al final sucede algo descoordinado, aumentando el riesgo de que el sistema se vuelva autoinmune.
Comentarios del Lector
a nuestro Boletín