Los niveles elevados de hidrógeno o gas metano indican que hay un crecimiento excesivo de bacterias, y se usa como evidencia para apoyar la adopción de un protocolo diseñado para matar dichas bacterias. Los protocolos típicamente involucran agentes procinéticos, enzimas digestivas, destructores de biofilm, hierbas botánicas antimicrobianas, antibióticos como la rifaximina, y quizás también probióticos. Aparte de la prescripción de una amplia gama de suplementos, a menudo se les dice a las personas que adopten una dieta baja en FODMAP o un protocolo más restrictivo del tipo GAPS para "matar de hambre a las bacterias", minimizar los síntomas y apoyar la integridad de la barrera intestinal.
Sin embargo, el SIBO es una afección notoriamente difícil de tratar exitosamente a largo plazo.
La tasa de recaída es alta después del tratamiento, con un pequeño estudio que muestra una recurrencia del 44% después de nueve meses.2 Para algunos individuos, una simple ronda de hierbas o antibióticos puede ser suficiente para aliviar permanentemente los síntomas. Mientras que para muchos otros, esta condición es un problema recurrente que puede persistir a pesar de intentar varios métodos de erradicación. Hay un sinnúmero de casos (que usted puede ver por sí mismo examinando foros en línea y grupos relacionados con la salud) de personas en las que esta condición parece prácticamente imposible de tratar. Incluso con todos los cambios recomendados en la dieta y en el estilo de vida, las cosas no parecen mejorar durante un período sostenido de tiempo. Las personas que no responden pueden verse obligadas a seguir una dieta baja en FODMAP/GAPS simplemente para controlar los síntomas porque no pueden tolerar ningún otro alimento.
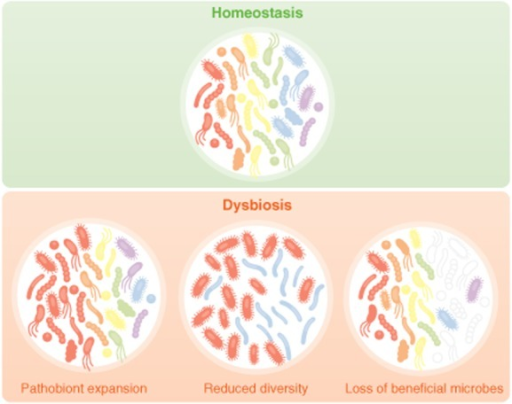
El enfoque de "bombardearlos" simplemente no es efectivo en algunos casos. Creo que la cuestión fundamental de este enfoque es que se basa en la noción de que el cuerpo humano es incapaz de regular o modular el funcionamiento dentro del intestino y, por lo tanto, necesita ser arreglado. Esta forma de ver el cuerpo es casi idéntica a la de la medicina ortodoxa, donde la única diferencia es que los médicos alternativos podrían usar hierbas y suplementos antimicrobianos en lugar de medicamentos farmacéuticos. La dinámica subyacente es similar, ya que las personas creen que pueden ser más inteligentes que su propia fisiología cargándose con suplementos. Esto es especialmente cierto para el SIBO o la disbiosis intestinal. Ahora, no me malinterpreten, los protocolos antimicrobianos de curación intestinal ciertamente tienen su lugar y claramente pueden ser muy beneficiosos. Yo mismo me he beneficiado inmensamente de este tipo de cosas en el pasado. Sin embargo, creo que, en algunos casos al menos, el SIBO no es un error o equivocación que necesite ser "arreglado" por medios ordinarios, como por ejemplo disparando al microbioma a toda potencia.
Según la filosofía naturopática, el cuerpo tiene la sabiduría innata y la inteligencia para sanarse a sí mismo cuando se le proporcionan las herramientas y condiciones adecuadas. Todavía no somos capaces de comprender plenamente la importancia de este concepto, pero afortunadamente las investigaciones están empezando a demostrar cómo podría funcionar.
Aunque sólo sea como un ejercicio mental interesante, trate de dar un paso atrás y observe la manifestación de problemas digestivos crónicos a través de una lente naturopática. ¿Podría el cuerpo realmente seleccionar la proliferación de bacterias específicas "malas" en el intestino para que éstas le provean de algo a lo que no tiene acceso? En otras palabras, ¿puede la disbiosis intestinal ser un intento de adaptación protectora y beneficiosa?
¿Puede el cuerpo regular las bacterias intestinales para satisfacer sus propias necesidades?
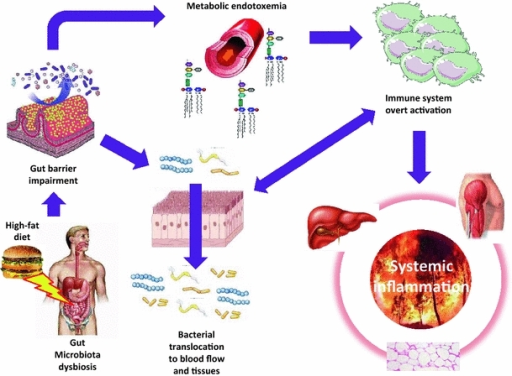
En las últimas décadas ha habido un auge de la investigación científica que investiga la conexión entre el microbioma y la salud humana. Los investigadores han demostrado vínculos causales potenciales entre los desequilibrios en la flora intestinal y una amplia gama de diferentes condiciones de salud, incluyendo la obesidad3, diabetes4, las condiciones autoinmunes5, e incluso el cancer.6 El cambio de las poblaciones bacterianas "sanas" en el intestino hacia un estado más "pro-inflamatorio" se acompaña de un aumento de los lipopolisacáridos, una endotoxina bacteriana capaz de alterar la integridad de la barrera intestinal y de inducir potencialmente una inflamación sistémica. El estado resultante del "intestino permeable" puede conducir a un sinnúmero de otros problemas.
Dado que la mayoría de las investigaciones realizadas en esta área han puesto de relieve las consecuencias negativas de los cambios proinflamatorios en las bacterias intestinales, la disbiosis es generalmente considerada como algo malo. Y esto es probablemente correcto en muchos casos. Sin embargo, en realidad hay algunas investigaciones que indican que los cambios proinflamatorios en el microbioma intestinal pueden tener un propósito beneficioso.
Uno de estos estudios publicado en 2014 se titulaba Adipocyte inflammation is essential for healthy adipose tissue expansion and remodelling8 ("La inflamación de los adipocitos es esencial para la expansión y remodelación saludable del tejido adiposo"). El estudio se realizó en tres tipos de ratones para medir los efectos que la inflamación local tenía en la expansión y remodelación del tejido adiposo. En resumen, demostraron que la señalización proinflamatoria en el adipocito (célula grasa) era esencial para remodelar la matriz extracelular y permitir el almacenamiento de más grasa. La alteración de la inflamación adipocitaria llevó a la acumulación de lípidos ectópicos, intolerancia a la glucosa e inflamación sistémica. ¡En términos básicos, demostraron que la inflamación en el tejido graso prevenía la disfunción metabólica! Lo que es más interesante es que la inflamación requerida para el proceso de remodelación fue producida por endotoxinas derivadas del intestino.
Los autores concluyeron:
"La inflamación del tejido adiposo es por lo tanto una respuesta adaptativa que permite el almacenamiento seguro del exceso de nutrientes y contribuye a una barrera de depósito visceral que filtra eficazmente la endotoxina derivada del intestino."En marcado contraste con la idea de que el "intestino permeable" es exclusivamente perjudicial, este estudio demostró que los cambios proinflamatorios en el microbioma intestinal eran probablemente una adaptación beneficiosa para promover la supervivencia. Así que parece que la inflamación intestinal puede ser buena en un contexto específico. Estos hallazgos también son significativos porque sugieren un cierto grado de inteligencia por parte del cuerpo, y apuntan a la posibilidad de que la modulación de las bacterias intestinales podría estar ocurriendo para satisfacer las necesidades del cuerpo.
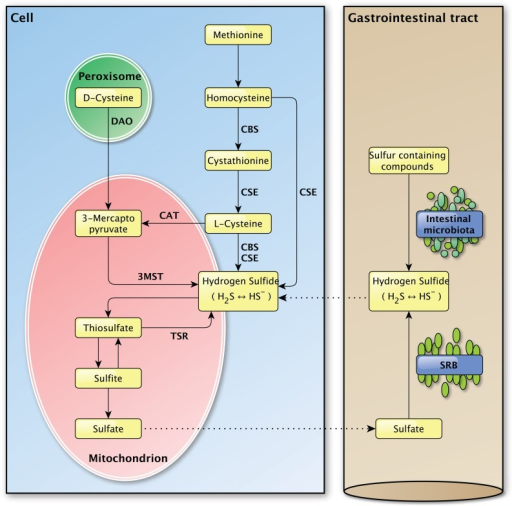
Otro estudio titulado Eukaryotic and prokaryotic contributions to colonic hydrogen sulfide synthesis9 ("Contribuciones eucariotas y procarióticas a la síntesis de sulfuro de hidrógeno colónico") se propuso medir la contribución de las bacterias intestinales a la cantidad total de gas de sulfuro de hidrógeno producido en el intestino. Cabe señalar aquí que el sulfuro de hidrógeno es un gas que desempeña muchas funciones fisiológicas (más sobre esto más adelante), y puede ser producido tanto por las células humanas como por ciertas bacterias mediante un conjunto de reacciones (en las que intervienen las enzimas CBS y CSE), utilizando la vitamina B6 como cofactor. Otras bacterias intestinales conocidas como bacterias reductoras de sulfato también pueden sintetizar el sulfuro de hidrógeno, pero en cambio no requieren que estas enzimas lo hagan.
Los investigadores alimentaron a un grupo de ratones con una dieta normal y al otro con una dieta deficiente en vitamina B6. Después de dos semanas, el contenido fecal de sulfuro de hidrógeno se redujo significativamente en los ratones con deficiencia de B6 (probablemente debido a la inhibición de las enzimas CBS y CSE). Sin embargo, después de seis semanas el contenido de sulfuro de hidrógeno fecal regresó a los mismos niveles que el grupo de control. En estos ratones, es probable que la dieta deficiente en B6 condujera a un mayor crecimiento de las "bacterias reductoras de sulfato", capaces de producir gas de sulfuro de hidrógeno sin la necesidad de B6.10 El autor del estudio continúa diciendo que "[estos hallazgos] pueden sugerir cambios en la microflora de estas ratas o en la producción de H2S a través de vías alternativas por parte de las bacterias del colon". En otras palabras, esta fue una respuesta adaptativa para compensar el déficit de B6 en la dieta. La población de bacterias intestinales cambió para satisfacer las necesidades del huésped.
Me parece que esto indica que existe una relación mutuamente beneficiosa entre el cuerpo y el microbioma, donde la comunicación y la cooperación parecen ser factores clave. ¿Acaso el cuerpo está eligiendo modular el crecimiento de bacterias específicas, o es al revés? Tal vez no sea ninguna de las dos cosas, ¡pero sin duda es un tema fascinante!
¿Es el sulfato la pieza que falta en el rompecabezas?
La Dra. Stephanie Seneff y sus colegas investigadores han escrito extensamente acerca de las posibles dinámicas mutuamente beneficiosas entre varios de los llamados "patógenos" y el cuerpo humano.11 El trabajo de Seneff se ha enfocado específicamente en el papel del sulfato en la fisiología y ha resaltado la habilidad de varios microorganismos para suministrar sulfato al cuerpo cuando éste se encuentra escaso. Un ejemplo es la Chlamydia Pnuemoniae. Con frecuencia se ha encontrado que esta bacteria coloniza el ateroma en casos de aterosclerosis12, un hallazgo que llevó a los investigadores a proponer que la infección era potencialmente una causa de la acumulación de placa.13 Por otro lado, Seneff y sus colegas han sugerido lo contrario: que la infección puede ser realmente una de las soluciones. Aquellos familiarizados con la teoría de Seneff sobre la aterosclerosis son probablemente conscientes de la importancia del sulfato para la salud y el mantenimiento del sistema cardiovascular. Si usted no está familiarizado con este material, entonces puede leer este artículo, o alternativamente puede referirse de nuevo a Sulfato III. En resumen, la C. Pneumoniae puede donar un tipo especial de sulfato de heparán para que sea utilizado por la célula huésped, y Seneff plantea la hipótesis de que el cuerpo puede facilitar específicamente el contagio de esta infección bacteriana y seleccionar su colonización para que ésta le suministre sulfato al endotelio capilar cuando no hay otras opciones disponibles.
Seneff también ha demostrado los vínculos entre el autismo y la deficiencia de sulfato en múltiples publicaciones. Curiosamente, se han detectado aumentos estadísticamente significativos en la presencia de C. Pneumoniae en la sangre en niños autistas.10 Además, también se ha encontrado que C. Pneumoniae está frecuentemente presente en la placa beta amiloide en pacientes con enfermedad de Alzheimer. Wendy A. Morely sugirió que ésta podría estar desempeñando un papel similar en la regeneración de sulfatos en una revisión14: "La Chlamydia pneumoniae produce una variante del HS usando un conjunto de enzimas que son exclusivas de esa especie, lo que sugiere que su presencia en el cerebro podría tener un papel beneficioso en la provisión del HS a los tejidos neurales".
La idea de que el cuerpo facilitaría específicamente el contagio y la colonización de bacterias potencialmente "patógenas" para que ayuden puede parecer una idea radical. Pero si volvemos a los principios básicos de la naturopatía, entonces podría empezar a tener sentido. Después de todo, el cuerpo parece tener una conciencia innata de lo que necesita, y la supervivencia del microbioma depende de la supervivencia del huésped.
Así que si este fuera de hecho el caso, ¿podrían entonces el SIBO y la disbiosis crónicos ser también una respuesta adaptativa para suministrar sulfatos adicionales?
El SIBO y la disbiosis como una forma de suministrar sulfato a pesar de las dificultades
Si usted ha leído los tres artículos anteriores de esta serie, debería ser capaz de apreciar el papel que juega el sulfato en el mantenimiento del estado de vida. Sin sulfato, es probable que la sangre no pueda fluir. Del mismo modo, es probable que la célula sea incapaz de realizar muchas otras funciones. En Sulfato III, hice hincapié en la probabilidad de que se dé prioridad a la sulfatación en detrimento de otros procesos. En pocas palabras, si no hay suficiente sulfato en los vasos sanguíneos y adherido a las células que flotan en la sangre, ésta se coagularía y moriríamos poco después.
Para una breve descripción general de los eventos que normalmente deberían ocurrir durante el metabolismo de los alimentos que contienen azufre, referiré al lector a Sulfato I: Lo Básico. El metabolismo del azufre involucra muchos procesos complejos y hay múltiples pasos que pueden ser perturbados. Afortunadamente, la Dra. Seneff y sus colegas han elucidado varias maneras en las que este camino puede ser realmente truncado simplemente por una exposición menor a toxinas ambientales bastante comunes. Los defectos en el metabolismo del azufre pueden incluir la deficiencia de cofactores, la insuficiencia de enzimas o la falta de métodos de transporte (entre otras cosas).
Por lo tanto, cuando las "rutas ordinarias" de transporte y metabolismo del azufre no están funcionando correctamente, el cuerpo debe encontrar otras maneras de realizar la tarea de manera eficiente. Por lo tanto, parece haber una variedad de "mecanismos de respaldo" para hacer esto que implican la modulación de las bacterias intestinales hacia un estado más "disbiótico" y pro-inflamatorio. Una de estas vías para transportar sulfato es a través de la síntesis bacteriana de gas de sulfuro de hidrógeno.
Pequeña introducción al sulfuro de hidrógeno
Aparte del hidrógeno y el metano, el SIBO puede presentar cantidades significativas de producción de gas de sulfuro de hidrógeno. De hecho, los autores de un estudio incluso concluyeron que la prueba de aliento de sulfuro de hidrógeno podría ser una manera más precisa de diagnosticar el SIBO que las pruebas de aliento estándar.15 Los estudios sugieren que los niveles fisiológicos de sulfuro de hidrógeno podrían jugar un papel importante en el mantenimiento de la barrera intestinal, la modulación de la respuesta inflamatoria, la modulación de la homeostasis vascular/circulatoria y la promoción de la producción de mucosa colónica. El gas también puede ser oxidado por las células del colon como fuente de energía para producir ATP. Desafortunadamente, sin embargo, los niveles excesivos han estado implicados en la patogénesis de la inflamación colónica, el síndrome del intestino irritable, la enfermedad inflamatoria intestinal (crohn, colitis ulcerosa) y el cáncer intestinal.16
Como mencioné brevemente arriba, el sulfuro de hidrógeno puede ser producido por una variedad de bacterias en el intestino. Las bacterias reductoras de sulfato (SRB) están presentes en todo el colon de los mamíferos y están compuestas predominantemente por los géneros Desulfovibrio, Desulfobacter, Desulfobulbus y Desulfotomaculu. Estas bacterias utilizan sulfato y sulfito sin necesidad de enzimas para alimentar su metabolismo, y producen gas de sulfuro de hidrógeno como subproducto. Para utilizar el sulfato o el sulfito, las SRB también requieren un donante de electrones como el hidrógeno (por lo que también podríamos asumir que el SIBO con dominio de hidrógeno proporciona un sustrato abundante para el exceso de crecimiento de las SRB). Las SRB derivan el azufre de fuentes dietéticas, pero también pueden co-colonizar otras bacterias que son capaces de descomponer los mucopolisacáridos en el revestimiento intestinal como otra fuente de azufre.17 No sólo promueven la descomposición del revestimiento intestinal, sino que el gas de sulfuro de hidrógeno también es capaz de inducir directamente el "intestino permeable".
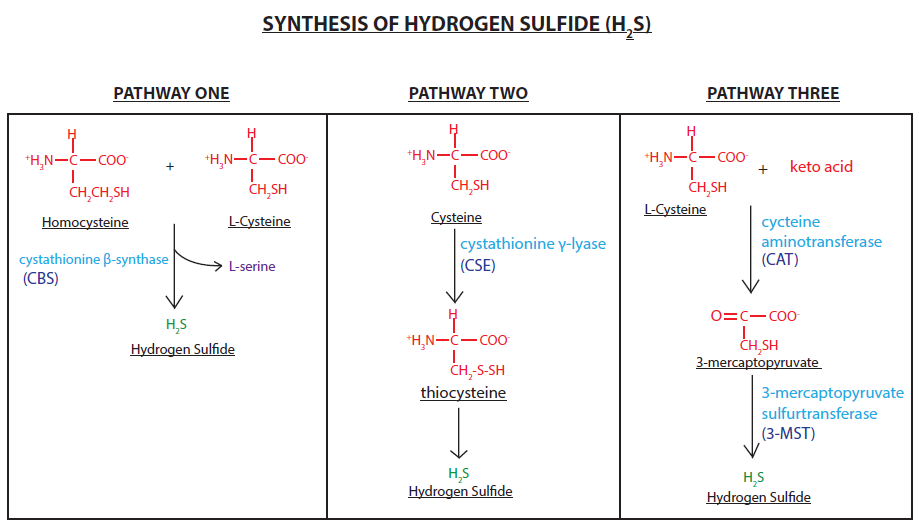
El sulfuro de hidrógeno puede causar algunos efectos bastante desagradables cuando se encuentra en cantidades elevadas, así que ¿cómo beneficiaría esto al cuerpo? Para responder a esta pregunta, primero necesitamos examinar algunas de las cosas que pueden salir mal con el metabolismo del azufre.
El sulfito es un intermediario en el metabolismo del azufre, pero también puede ser ingerido a través de fuentes dietéticas. El sulfito es extremadamente tóxico y puede causar un daño oxidativo significativo, por lo que es importante que el cuerpo lo convierta rápidamente en sulfato. La conversión de sulfito a sulfato se basa en una enzima llamada sulfito oxidasa (SUOX) que utiliza el molibdeno como cofactor.
Si esta enzima no está funcionando correctamente, puede causar dos problemas:
- La acumulación tóxica de sulfito
- Deficiencia de sulfato
- Deficiencia de molibdeno: El herbicida común a base de glifosato (Roundup Ready) es un potente quelante del molibdeno.
- Sustitución de glifosato por glicina en la síntesis de proteínas: La enzima SUOX contiene residuos críticos de glicina que teóricamente podrían ser reemplazados por glifosato durante la síntesis de proteínas - un proceso que puede hacer que la enzima SUOX sea disfuncional.
- Toxicidad por mercurio y plomo: Interfieren con la función enzimática.
- Polimorfismo genético de la SUOX: Un polimorfismo de un solo nucleótido en el gen de la SUOX puede interferir con la velocidad y eficiencia por la cual esta enzima puede realizar su función.
Para agravar este problema, la enzima (sulfito reductasa asimilativa) responsable de la síntesis bacteriana de metionina a partir de sulfito también se ve afectada por el glifosato. La metionina es un aminoácido esencial, lo que significa que debe provenir de fuentes dietéticas o de la síntesis bacteriana. La acción inhibitoria del glifosato sobre esta enzima puede contribuir aún más al exceso de sulfito, y también puede conducir potencialmente a la insuficiencia de metionina. Por lo tanto, en este escenario el cuerpo debe encontrar otra manera de deshacerse de la acumulación tóxica de sulfito en el intestino. Afortunadamente, muchas de nuestras bacterias pueden hacer este trabajo por nosotros.
Según Seneff et al19:
"Una deficiencia de sulfito oxidasa estimularía el crecimiento de microbios capaces de reducir el sulfito altamente tóxico a un H2S menos tóxico, lo que alteraría la estrecha barrera que impide que los microbios y las toxinas que producen penetren en la circulación general.Recordemos el estudio que mencioné al principio del artículo que mostró que el microbioma de los ratones con deficiencia de vitamina B6 se adaptó aumentando el crecimiento de las bacterias reductoras de sulfato. Creo que un mecanismo similar podría ocurrir como una adaptación a un metabolismo deficiente de azufre. Curiosamente, se ha demostrado que con frecuencia se produce un crecimiento excesivo de la Desulfovibrio en casos de autismo (lo cual Seneff cree que está relacionado con la deficiencia de sulfato).
[..]
Se puede plantear la hipótesis de que, como consecuencia del deterioro de la capacidad de la E. coli para incorporar el átomo de azufre del sulfito en compuestos orgánicos de azufre, la sulfito reductasa disimilativa de la Desulfovibrio produce H2S a partir del sulfito".
Las bacterias reductoras de sulfato pueden tomar el sulfito (muy tóxico) y convertirlo en sulfuro de hidrógeno (mucho menos tóxico). El sulfuro de hidrógeno puede ser convenientemente oxidado rápidamente de nuevo y convertido en sulfato cuando ha alcanzado el tejido objetivo a través de la enzima sulfido-quinona-reductasa. Los principales objetivos del sulfuro de hidrógeno parecen ser el hígado, el páncreas y la columna vertebral.
Por lo tanto, este método no sólo reduce la carga tóxica del sulfito, sino que también es un método ingenioso para transportar el sulfato alrededor del cuerpo cuando los métodos de transporte son limitados.
Problemas con el transporte de sulfato
Un estudio titulado Glyphosate's Suppression of Cytochrome P450 Enzymes and Amino Acid Biosynthesis by the Gut Microbiome: Pathways to Modern Diseases ("Supresión de las enzimas citocromáticas P450 por el glifosato y biosíntesis de aminoácidos por el microbioma intestinal: la vía a las enfermedades modernas"), de Samsel y Seneff, destaca la posibilidad de que la contaminación por glifosato en los vasos sanguíneos pueda obstaculizar potencialmente la ruta del sulfato libre en la sangre. Al igual que el sulfato, el glifosato es también un fuerte kosmotropo aniónico con la capacidad de estructurar las moléculas de agua circundantes (ver Sulfato III para más detalles).
Según los autores, la presencia de glifosato en la vena porta hepática puede interrumpir el transporte de sulfato libre desde el intestino hasta el hígado. La elevada carga kosmotrópica (debido a las propiedades kosmotrópicas del glifosato) significa que el transporte libre de sulfato potencialmente "gelificaría" la sangre excesivamente, y por lo tanto sería demasiado peligroso.
Como ruta de remedio, los compuestos químicamente adecuados, como los fenoles, pueden dispersar las propiedades kosmotrópicas del sulfato, por lo que pueden utilizarse para transportar el sulfato a través de la sangre incluso en presencia de glifosato en los vasos sanguíneos. Los aminoácidos aromáticos pueden ser metabolizados por las bacterias en el intestino para producir una variedad de fenoles adecuados para este propósito. Desafortunadamente, muchos de estos fenoles derivados de bacterias se vuelven tóxicos una vez que han "dejado caer" el sulfato en el hígado, por lo que inevitablemente causarán algún daño.
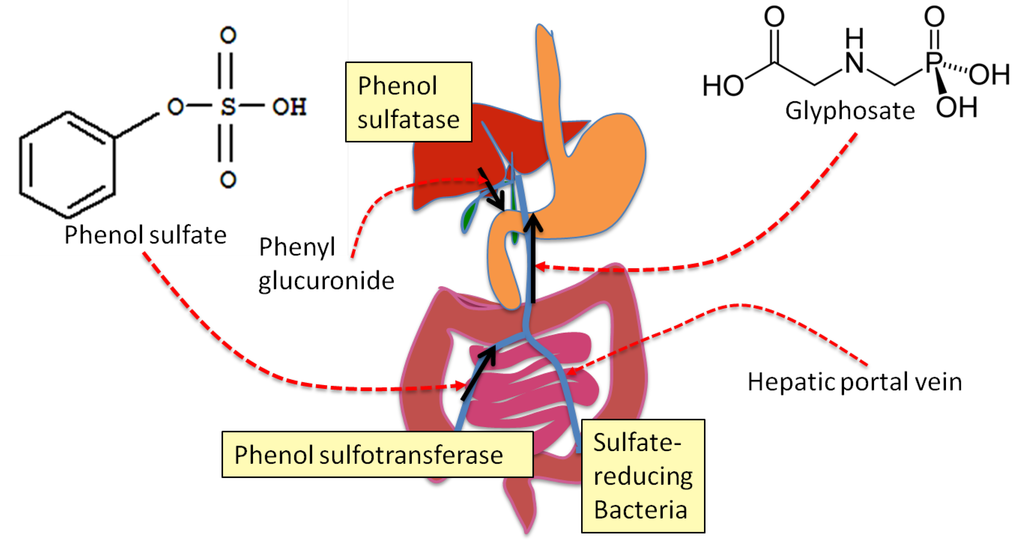
Como dije antes, el sulfuro de hidrógeno puede ser oxidado directamente en el tejido a través del SQR para convertirlo en sulfato. En otras palabras, este puede ser un mecanismo de apoyo para el transporte de sulfato cuando no hay otra opción.
Por lo tanto, tendría sentido que, en respuesta a la disfunción enzimática inducida por la toxicidad y a la falta de transporte, una respuesta adaptativa por parte del cuerpo fomentaría un crecimiento excesivo de bacterias reductoras de sulfato y también de otros "patógenos" como la Clostridia. Parece que este proceso de disbiosis adaptativa es multifacético y podría manifestarse de varias maneras diferentes dependiendo de cada individuo. Podría presentarse como un crecimiento excesivo de las SRB, las reductoras de sulfitos asimilatorios como la E. Coli, las productoras de fenol como la Clostridia, o incluso las tres.
Como nota al margen, es interesante que el SIBO está significativamente correlacionado con la enfermedad cardiovascular. Se ha demostrado que es más frecuente en las enfermedades de las arterias coronarias21, la trombosis venosa profunda22 y la aterosclerosis.23 Por supuesto, esta asociación puede explicarse por varios mecanismos diferentes. Sin embargo, cuando se coloca en el contexto del trabajo de la Dra. Seneff sobre el sulfato y su relación con la disfunción cardiovascular, es quizás posible que algunos de los cambios proinflamatorios en la flora intestinal puedan estar contribuyendo a este apoyo del suministro de sulfato. Para más información, puede escuchar la entrevista que le hicimos a la Dra. Seneff en el programa Health & Wellness de Sott.net aquí.
Me gustaría dejar claro que el glifosato, la toxicidad de metales pesados y todas las demás influencias que contribuyen a la disbiosis intestinal pueden inducir independientemente estos efectos por sí solos, y que no creo que cada caso de SIBO sea una respuesta adaptativa al suministro de sulfato. Para muchas personas, puede no tener nada que ver con el sulfato. El SIBO y la disbiosis intestinal pueden causar estragos en el cuerpo, por lo que es esencial que nuestro objetivo sea optimizar la digestión y la salud intestinal en general.
Sin embargo, para mí tiene un sentido intrínseco que el cuerpo intente tomar las mejores decisiones posibles basándose en las limitadas opciones disponibles en momentos de estrés. Como último intento desesperado de suministrar sulfato, creo que es posible que el cuerpo sacrifique otras funciones que se consideran no esenciales para la supervivencia inmediata. Algo que parece ser patológico puede ser parte de la solución.
Beneficios de la disbiosis en el contexto de la reposición de sulfato
En resumen, a continuación se presentan algunos de los beneficios potenciales del crecimiento excesivo de bacterias cuando el metabolismo del sulfato no está funcionando adecuadamente:
- Neutralización de sulfitos: Las bacterias reductoras de sulfatos y de sulfitos asimilatorios eliminan el exceso de sulfitos para mitigar el daño oxidativo a los componentes celulares.
- Transporte de sulfuro de hidrógeno: Las bacterias reductoras de sulfato pueden convertir el azufre en gas de sulfuro de hidrógeno que puede ser absorbido por el torrente sanguíneo o puede difundirse a través de los tejidos para ser oxidados en el sitio y transformarse de nuevo en sulfato.
- Transporte de fenol: La Clostridia y otros patógenos producen compuestos fenólicos (como HPHPA, P-Cresol, etc.) que pueden transportar con seguridad el sulfato a través de la sangre hasta el hígado.
Como ya he mencionado, el metabolismo del azufre es complejo. No sólo involucra a todas las enzimas directamente relacionadas con el azufre, sino que también puede verse afectado negativamente si hay interrupciones en otras vías como la metilación. Afortunadamente, ese aspecto de las cosas se ha explicado a fondo en muchos otros lugares y está fuera del alcance de este artículo. A este respecto, me gustaría esbozar brevemente algunas de las cosas que la gente puede hacer para ayudar a aliviar algunos de sus problemas de salud. Las recomendaciones a continuación han sido tomadas del Dr. Greg Nigh y colegas que han desarrollado un protocolo diseñado para personas con un metabolismo deficiente del azufre.
Si uno de los siguientes puntos se aplica a usted, es posible que tenga problemas para metabolizar el azufre:
- Ha probado protocolos antimicrobianos pero aún sufre de problemas intestinales crónicos: síntomas típicos del SIBO
- Enrojecimiento, aparición de calor o síntomas relacionados con el calor: sofocos, eczema, urticaria, acné quístico
- Experimenta cualquier otro problema de la piel
- Experimenta neblina mental, concentración y memoria pobre
- Poca tolerancia al alcohol
- Tiene una reacción a alimentos que contienen sulfuro como los huevos, las cebollas, el puerro, los vegetales crucíferos
- Molibdeno (para apoyar la enzima SUOX)
- Butirato (para apoyar la integridad de la barrera intestinal)
- Acetato de zinc (para reducir el sulfuro de hidrógeno)
- Hidroxocobalamina sublingual (para adherirse al sulfuro de hidrógeno)
- Bismuto (para reducir la producción de sulfuro de hidrógeno en el intestino)
- Probióticos
¡Otro punto clave es evitar el glifosato a toda costa! Esto significa comer orgánico siempre que sea posible. Cuando lo orgánico no es una opción, por lo menos manténgase alejado de los alimentos fuertemente rociados con glifosato - maíz, soja, trigo, garbanzos, lentejas, etc. También puede ser aconsejable hacerse pruebas para detectar la contaminación por glifosato. De manera similar, la toxicidad de los metales pesados también puede ser un factor contribuyente. Si usted sospecha que ése es el caso, entonces sería prudente tomar las medidas necesarias en esa dirección (análisis y quelación bajo la supervisión de un profesional capacitado).
Para más información sobre el protocolo del Dr. Nigh, puede escuchar este podcast o ver el seminario en vídeo a continuación:
Referencias
- Bures, J. (2010). Small intestinal bacterial overgrowth syndrome. World Journal of Gastroenterology, 16(24), p.2978.
- Lauritano, E., Gabrielli, M., Scarpellini, E., Lupascu, A., Novi, M., Sottili, S., Vitale, G., Cesario, V., Serricchio, M., Cammarota, G., Gasbarrini, G. and Gasbarrini, A. (2008). Small Intestinal Bacterial Overgrowth Recurrence After Antibiotic Therapy. The American Journal of Gastroenterology, 103(8), pp.2031-2035.
- Omer, E. and Atassi, H. (2017). The Microbiome That Shapes Us: Can It Cause Obesity?. Current Gastroenterology Reports, 19(12)
- Sohail, M., Althani, A., Anwar, H., Rizzi, R. and Marei, H. (2017). Role of the Gastrointestinal Tract Microbiome in the Pathophysiology of Diabetes Mellitus. Journal of Diabetes Research, 2017, pp.1-9.
- Proal, A., Albert, P. and Marshall, T. (2013). The human microbiome and autoimmunity. Current Opinion in Rheumatology, 25(2), pp.234-240.
- Bhatt, A., Redinbo, M. and Bultman, S. (2017). The role of the microbiome in cancer development and therapy. CA: A Cancer Journal for Clinicians, 67(4), pp.326-344.
- D'Argenio, V. and Salvatore, F. (2015). The role of the gut microbiome in the healthy adult status. Clinica Chimica Acta, 451, pp.97-102.
- Wernstedt Asterholm, I., Tao, C., Morley, T., Wang, Q., Delgado-Lopez, F., Wang, Z. and Scherer, P. (2014). Adipocyte Inflammation Is Essential for Healthy Adipose Tissue Expansion and Remodeling. Cell Metabolism, 20(1), pp.103-118.
- Flannigan, K., McCoy, K. and Wallace, J. (2011). Eukaryotic and prokaryotic contributions to colonic hydrogen sulfide synthesis. American Journal of Physiology-Gastrointestinal and Liver Physiology, 301(1), pp.G188-G193.
- D'Argenio, V. and Salvatore, F. (2015). The role of the gut microbiome in the healthy adult status. Clinica Chimica Acta, 451, pp.97-102.
- Seneff, S., Lauritzen, A., Davidson, R. and Lentz-Marino, L. (2013). Is Encephalopathy a Mechanism to Renew Sulfate in Autism?. Entropy, 15(1), pp.372-406.
- Borel, N., Summersgill, J., Mukhopadhyay, S., Miller, R., Ramirez, J. and Pospischil, A. (2008). Evidence for persistent Chlamydia pneumoniae infection of human coronary atheromas. Atherosclerosis, 199(1), pp.154-161.
- Honarmand, H. (2013). Atherosclerosis Induced byChlamydophila pneumoniae: A Controversial Theory. Interdisciplinary Perspectives on Infectious Diseases, 2013, pp.1-11.
- Seneff, S. and Morley, W. (2014). Diminished brain resilience syndrome: A modern day neurological pathology of increased susceptibility to mild brain trauma, concussion, and downstream neurodegeneration. Surgical Neurology International, 5(1), p.97.
- Banik, G., De, A., Som, S., Jana, S., Daschakraborty, S., Chaudhuri, S. and Pradhan, M. (2016). Hydrogen sulphide in exhaled breath: a potential biomarker for small intestinal bacterial overgrowth in IBS. Journal of Breath Research, 10(2), p.026010
- V. Kushkevych, I. (2014). Etiological Role of Sulfate-Reducing Bacteria in the Development of Inflammatory Bowel Diseases and Ulcerative Colitis. American Journal of Infectious Diseases and Microbiology, 2(3), pp.63-73.
- Tomasova, L., Konopelski, P. and Ufnal, M. (2016). Gut Bacteria and Hydrogen Sulfide: The New Old Players in Circulatory System Homeostasis. Molecules, 21(11), p.1558
- Lee, H., Kho, H., Chung, J., Chung, S. and Kim, Y. (2006). Volatile Sulfur Compounds Produced by Helicobacter pylori. Journal of Clinical Gastroenterology, 40(5), pp.421-426
- Seneff, S., Causton, N., Nigh, G., Koenig, G. and Avalon, D. (2017). Can glyphosate's disruption of the gut microbiome and induction of sulfate deficiencyexplain the epidemic in gout and associated diseases in the industrialized world?. Journal of Biological Physics and Chemistry, 17(2), pp.53-76.
- Shaw W. Elevated Urinary Glyphosate and Clostridia Metabolites With Altered Dopamine Metabolism in Triplets With Autistic Spectrum Disorder or Suspected Seizure Disorder: A Case Study. Integrative Medicine: A Clinician's Journal. 2017;16(1):50-57.
- Fialho, A., Fialho, A., Kochhar, G., Schenone, A., Thota, P., McCullough, A. and Shen, B. (2017). Association Between Small Intestinal Bacterial Overgrowth by Glucose Breath Test and Coronary Artery Disease. Digestive Diseases and Sciences, 63(2), pp.412-421.
- Cheng, X., Zhang, L., Xie, N., Xu, H. and Lian, Y. (2017). Association between small-intestinal bacterial overgrowth and deep vein thrombosis in patients with spinal cord injuries. Journal of Thrombosis and Haemostasis, 15(2), pp.304-311.
- Ponziani, F., Pompili, M., Di Stasio, E., Zocco, M., Gasbarrini, A. and Flore, R. (2017). Subclinical atherosclerosis is linked to small intestinal bacterial overgrowth via vitamin K2-dependent mechanisms. World Journal of Gastroenterology, 23(7), p.1241.




Comentarios del Lector
a nuestro Boletín