Puede descargar el estudio original en inglés aquí.
Resumen
- El tema más controvertido sobre las vacunas de ARNm es si dicho material genético se puede mezclar o no con nuestro ADN permanentemente y las posibles complicaciones que este hecho pueden producir. Los fabricantes de este tipo de vacunas afirman que después de la traducción, el ARNm sintético será degradado por las enzimas del huesped y no interactuará con el genoma del huésped. En este articulo demostraremos que esta afirmación puede ser incorrecta y que la aplicación de una vacuna sin garantía total de que no modificará nuestro código genético es un claro error. Aplicarlo a miles de millones de personas es una total imprudencia.
- El uso de ARNm en una vacuna puede inducir alteraciones genéticas que se puede transmitir a la descendencia a través del esperma afectado, pero su uso especialmente en mujeres embarazadas podría producir una mutagénesis del células en crecimiento del feto, alterando la diferenciación inherente a la formación de órganos en desarrollo [71].
- Hasta ahora, las vacunas de ARNm nunca se habían utilizado clínicamente, por lo que estas declaraciones no han sido probadas de manera confiable a nivel clínico. Muchos investigadores independientes plantean la cuestión de la alta semejanza y que dicho material genético acabará formando parte de nuestro cromosomas.
El material genético ARNm puede introducirse en nuestro genoma
Las empresas comerciales que fabrican vacunas de ARNm, los funcionarios de salud del gobierno y algunas universidades aseguran firmemente que dicho material genético no puede introducirse en nuestro genoma. Se basan en el concepto de unidireccionalidad del flujo de información genética celular para afirmar que no hay posibilidad de mutagénesis de nuestro ADN mediante la inserción de ARNm, ya que es literalmente imposible que entre en el núcleo celular.
Los únicos argumentos "probatorios" para esta afirmación son:
- 1.- Imposibilidad de la unión física al ADN: el ARNm no puede pasar del citoplasma al núcleo debido al efecto barrera que la membrana nuclear supone [20] y debido a que el ARNm es degradado naturalmente después de la traducción en proteínas en el citosol [21].
- 2.- Ausencia de transcriptasa inversa (RT): Afirman que, incluso si lograra ingresar al núcleo, no podría convertirse en ADN y entrar en nuestro genoma ya que no hay transcriptasa inversa, RT que permita tal conversión.
La primera de estas declaraciones que rechazan cualquier riesgo de mutagénesis se basa en la idea simplista de que el ADN del núcleo es
transcrito en ARNm que atraviesa la membrana nuclear y cuando llega al citoplasma se traduce en proteínas por los ribosomas. Está perfectamente probado que el ADN-ARNm-> El proceso de proteínas no es un proceso exclusivamente unidireccional y que la vía retrógrada es perfectamente posible. A continuación el estudio describe 4 situaciones en las que esto puede suceder: las dos primeras en células en división celular y las dos siguientes en células en interfase.
Durante la división celular
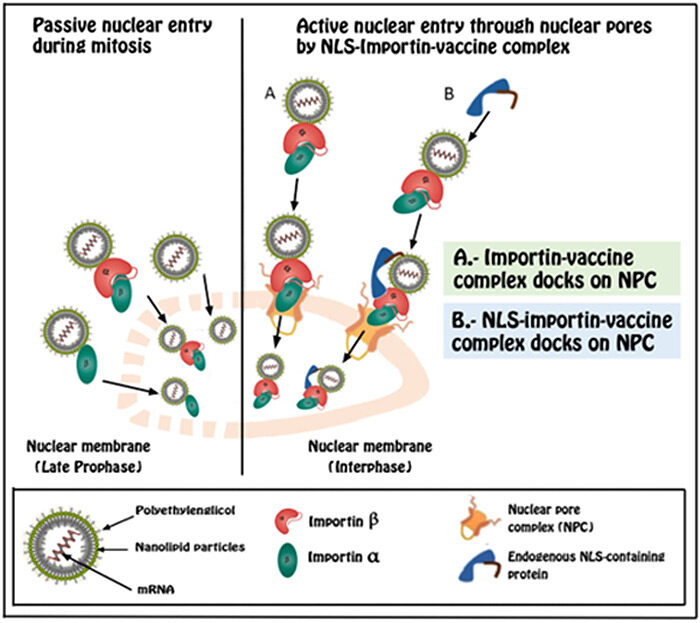
La biología elemental nos enseña que durante la división celular (mitosis y meiosis), hay fases en las que la membrana nuclear desaparece y los cromosomas se mezclan con el citoplasma. Después de estas fases, se reconstruye la membrana nuclear, y sería perfectamente posible que el ARNm de las vacunas sea incluido dentro del nuevo núcleo [22].
Es cierto que los cromosomas son material empaquetado genéticamente, al que el nuevo material genético no se puede adjuntar . Sin embargo, después de las divisiones celulares, una nueva membrana se vuelve a crear, y los cromosomas vuelven a una situación conformacional no compactada.
Esta descondensación de los cromosomas da lugar a que la cromatina, que representa un estado completamente funcional de nuestro ADN. En estas condiciones, la introducción del ARNm de la vacuna en nuestro material genética es solo cuestión de tiempo y probabilidades estadísticas [23, 24].
Mitosis
Como podemos ver, durante la mitosis hay una reorganización total de la material celular durante la cual, las moléculas presentadas en el citoplasma celular (proteínas, lípidos, ARNm) puede acabar incluyéndose durante la telofase dentro del nuevo núcleo celular (Figura 1) y más tarde unir nuestro ADN a través de una RT.
Meiosis I y II
Como en la prometafase de la mitosis, durante la prometafase de meiosis I y II, se produce una fragmentación de la membrana nuclear en vesículas múltiples. De la misma manera, durante ambas fases de la meiosis, se produce una reorganización total del material celular durante la cual, las moléculas presentes en el citoplasma celular (proteínas, lípidos, ARNm) pueden terminar envueltos dentro del nuevo núcleo celular y por lo tanto unirse a nuestro ADN de la misma forma que en la mitosis (Figura 1). Sin embargo, en este caso, las consecuencias pueden ser más graves porque dicha mutación genética se transmitiría a nuestra descendencia [29-31].
Antecedentes de riesgo de infección inducida por fragmentos de ADN humano y retroviral
En un ensayo inicial de terapia génica, expertos de la División de Terapia Génica de la FDA estimaron que el riesgo de infección inducida por fragmentos de ADN humano y retroviral que cause mutaciones y cáncer era de 1 en un billón. Trágicamente, cuando el se administraron fragmentos de ADN retrovírico y humano a niños con enfermedad SC1D en un ensayo de terapia génica, 4 de 9 (44%) de los niños desarrollaron leucemia [65]. La subestimación del riesgo debe avergonzar a aquellos que hicieron tales predicciones .
Los autores Zhang L et al [70] estudiaron específicamente la posibilidad de que el ARN del SARS-CoV-2 se transcribe de forma inversa y se integra en el genoma humano. Demostraron experimentalmente que su ARN puede ser transcrito de forma inversa en células humanas por RT de elementos LINE-1 o por RT del VIH-1, y que estas secuencias de ADN se pueden integrar en el genoma celular y posteriormente ser transcrito.
Expresión de LINE-1 humana endógena fue inducida después de la infección por SARS-CoV-2 o por exposición a citocinas en células cultivadas, lo que sugiere una mecanismo de retrointegración del SARS-CoV-2 en pacientes.
La nueva característica de la infección por SARS-CoV-2 puede explicar por qué los pacientes puede continuar produciendo ARN viral después de la recuperación y podría ser un vía para que el ARNm de la vacuna ingrese al núcleo celular.
El uso de ARNm en una vacuna puede inducir alteraciones genéticas que se puede transmitir a la descendencia a través del esperma afectado, pero su uso especialmente en mujeres embarazadas podría producir una mutagénesis del células en crecimiento del feto, alterando la diferenciación inherente a la formación de órganos en desarrollo [71].
Nanopartículas lipídicas (LNP) y polietilenglicol (PEG)
Las "pseudovacunas" de Moderna y Pfizer-BioNTech para COVID-19 contienen ARNm envuelto por nanopartículas lipídicas (LNP) y polietilenglicol (PEG). Ninguno de estos 3 componentes han sido aprobados para vacunas o medicamentos parenterales (inyectables). La investigación ha mostrado que los LNP ingresan fácilmente al cerebro y pueden desencadenar reacciones inmunes, especialmente después de la segunda dosis.
Más del 70% de la población estadounidense es alérgica al PEG, por lo que estos las vacunas pueden causar reacciones alérgicas y anafilaxia. Existen sospechas fundadas de que estas vacunas pueden insertarse en nuestro ADN, provocando mutaciones cuyo impacto se desconoce y que incluso podrían transmitirse a nuestra descendencia. Explicamos cómo el ARNm existente en el citosol celular puede ingresar al núcleo tanto durante la división celular (mitosis y meiosis) como en reposo (interfase). Además, las posibles rutas de integración de ADN y ARN en nuestros cromosomas a través de la transcripasas inversa (RT) se ven especialmente en los espermatozoides donde una RT endógena específica ha sido identificada.
¿Cómo pueden asegurar de que esta vacuna no se integre en nuestro genoma?
Simplemente no podemos aceptar que esta inyección (pseudo vacuna) no lo hará, especialmente cuando no hay estudios específicos llevados a cabo a nivel preclínico para evaluar dicho efecto. También sabemos que las células eucariotas tienen sus propios RT endógenos y que son capaces de convertir ARN en ADN, ¿cómo pueden asegurar de que esta vacuna no se integre en nuestro genoma? Hay demasiadas dudas al respecto para autorizar el uso clínico de inyecciones, de este tipo.
Los fabricantes de inyecciones de ARNm afirman que como no usan el virus completo, su uso no puede infectar los vacunados. Sin embargo, desde que comenzó la vacunación en las residencias de ancianos, se han originado infecciones masivas y muertes entre los ancianos. Este es un hecho clínico innegable, y nadie da una respuesta adecuada a por qué se originan estas infecciones poco después de la vacunación [77,78]. En nuestra opinión, es indiscriminado el uso en cientos de millones de personas en todo el mundo para prevenir una enfermedad con una mortalidad en la población general entre 0,3 y el 1% [79] es simplemente una falta imprudente en sentido ético.
Referencias:
- Wu F, Zhao S, Yu B, Chen YM, Wang W, et al. (2020) A new coronavirusassociated with human respiratory disease in China. Nature 579: 265-269.
- Wang C, Horby PW, Hayden FG, Gao GF (2020) A novel coronavirusoutbreak of global health concern. Lancet 395: 470-473.
- Pardi N, Hogan MJ, Porter FW, Weissman D (2018) mRNA vaccines. Anew era in vaccinology. Nat Rev Drug Discov 17(4): 261-279.
- Lavarone C, O'hagan DT, Yu D, Delahaye NF, Ulmer JB, et al. (2017)Mechanism of action of mRNA-based vaccines. Expert Rev Vaccines16(9): 871-881.
- https://www.modernatx.com/modernas-work-potential-vaccineagainst-covid-19
- https://www.nytimes.com/2020/11/20/health/covid-vaccine-95-effective.html
- Hodgson S, Mansatta K, Mallet G, Harris V, Emary K, et al. (2021) Whatdefines an efficacious COVID-19 vaccine? A review of the challengesassessing the clinical efficacy of vaccines against SARS-CoV-2. LancetInfect Dis 21(2): e26-35.
- https://www.nytimes.com/2015/03/10/health/protection-without-avaccine.html
- Chung Y, Beiss V, Fiering S, Steinmetz N (2020) COVID-19 Vaccinefrontrunners and their nanotechnology design. ACS Nano 14(10):12522-12537.
- Buschmann M, Carrasco M, Alishetty S, Paige M, Alameh M, et al. (2021)Nanomaterial Delivery Systems for mRNA Vaccines. Vaccines 9(1): 65.
- https://childrenshealthdefense.org/news/components-of-mrnatechnology-could-lead-to-significant-adverse-events-in-one-or-moreof-our-clinical-trials-says-moderna/
- https://anthraxvaccine.blogspot.com/2021/01/maine-emts-beinggiven-false-and.html
- https://www.fda.gov/media/144246/download
- https://www.statnews.com/2017/01/10/moderna-trouble-mrna/
- h t t p s : / / w w w . s e c . g o v / A r c h i v e s / e d g a r /data/1682852/000119312518323562/d577473ds1.htm
- Dai L, Gao G (2021) Viral targets for vaccines against COVID-19. NatureReviews Immunology volume 21: 73-82.
- Blakney A, Ip S, Geall A (2021) An update on self-amplifying mRNAvaccine development. Vaccines 9(2): 97.
- Xu S, Yang K, Li R, Zhang L (2020) mRNA Vaccine Era-Mechanisms, drugplatform and clinical prospection. Int J Mol Sci 21(18): 6582.
- Griffiths D (2001) Endogenous retroviruses in the human genomesequence. Genome Biol 2(6).
- Sahin U, Karikó K, Türeci Ö (2014) mRNA-based therapeutics-developinga new class of drugs. Nat Rev Drug Discov 13: 759-780.
- Guevara ML, Persano S, Persano F (2019) Lipid-based vectors fortherapeutic mRNA-based anti-cancer vaccines. Curr Pharm Des 25(13):1443-1454.
- O'Connor C (2008) Cell Division: Stages of Mitosis. Nature Education1(1): 188.
- Cheeseman IM, Desai A (2008) Molecular architecture of the kinetochoremicrotubuleinterface. Nature Reviews Molecular Cell Biology 9(1): 33-46.
- Hagstrom KA, Meyer BJ (2003) Condensin and cohesin: More thanchromosome compactor and glue. Nature Reviews Genetics 4: 520-534.
- Cremer T, Cremer C (2001) Chromosome territories, nuclear architectureand gene regulation in mammalian cells. Nature Reviews Genetics 2:292-301.
- Hirano T (2002) At the heart of the chromosome: SMC proteins in action.Nature Reviews Molecular Cell Biology 7: 311-322.
- Paweletz N (2001) Walther Flemming: Pioneer of mitosis research.Nature Reviews Molecular Cell Biology 2: 72-75.
- Ohkura H (2015) Meiosis an overview of key differences from mitosis.Cold Spring Harb Perspect Biol 7(5): a015859.
- Grelon M (2016) Meiotic recombination mechanism. C R Biol 339(7-8):2472-2451.
- Eguizabal C, Montserrat N, Vassena R, M Barragan, E Garreta, et al.(2011) Complete meiosis from human induced pluripotent stem cells.Stem Cells 29(8): 1186‐1195.
- Arbel A, Simchen G (2019) Elevated mutagenicity in meiosis and itsmechanism. Bioessays 41(4): e1800235.
- Rangel G, Alves R (2017) Gene therapy: advances, challenges andperspectives. Einstein (Sao Paulo) 15(3): 369-375.
- Ni R, Feng R, Chau Y (2019) Synthetic Approaches for Nucleic AcidDelivery: Choosing the Right Carriers. Life (Basel) 9(3): 59.
- Mieruszynski S, Digman MA, Gratton E, Jones MR (2015) Characterizationof exogenous DNA mobility in live cells through fluctuation correlationspectroscopy. Sci Rep 5: 13848.
- Panté N, Kann M (2002) Nuclear Pore Complex Is Able to TransportMacromolecules with Diameters of about 39nm. Mol. Biol. Cell 13(2):425-434.
- Diana Y Vargas, Arjun Raj, Salvatore A E Marras, Fred Russell Kramer,Sanjay Tyagi, et al. (2005) Mechanism of mRNA transport in the nucleus.Proc Natl Acad Sci USA 102(47): 17008-17013.
- Rong Ni, Ruilu Feng, Ying Chau (2019) Synthetic Approaches for NucleicAcid Delivery: Choosing the Right Carriers. Life (Basel) 9(3): 59.
- Luqye JC (2012) The invisibility cloak "for nanoparticles. Rev CienciasUniv Pablo Olavide. 6: 101-103.
- Zhanga P, Suna F, Liub S, Jianga S (2016) Anti-PEG antibodies in theclinic: current issues and beyond PEGylation. J Control Release 244(ptB): 184-193.
- Garay R, El-Gewely R, Armstrong J, Garratty G, Richette P, et al. (2012)Antibodies against polyethylene glycol in healthy subjects and inpatients treated with PEGconjugated agents. Expert Opinion on DrugDelivery 9(11): 1319-1323.
- Yang Qi Jacobs T, McCallen J, Moore D, Huckaby J, Eldestein J, et al. (2016)Analysis of pre-existing IgG and IgM antibodies against PolyethyleneGlycol (PEG) in the general population. Anal Chem 88(23): 11804-11812.
- https://www.sciencemag.org/news/2020/12/suspicions-grownanoparticles-pfizer-s-covid-19-vaccine-trigger-rare-allergic-reactions
- Arana L, Bayo L, Sarasola L, Berasategui M, Ruiz S, et al. (2019)Chemotoxic treatment in an oral carcinoma cell Line. Nanomaterials9(3): 464.
- Guevara M, Persano F, Persano S (2020) Advances in Lipid Nanoparticlesfor mRNA-Based Cancer Immunotherapy. Frontiers in chemestry 20208: 589959.
- Kranz LM, Diken M, Haas H, Kreiter S, Loquai C, et al. (2016) SystemicRNA delivery to dendritic cells exploits antiviral defence for cancerimmunotherapy. Nature 534: 396-401.
- Reichmuth A, Oberti M, Jaklenec A, Langer R, Blankschtein D, et al.(2016) mRNA vaccine delivery using lipid nanoparticles. Ther Deliv7(5): 319-334
- Gómez I, Rodriguez J, Vicente M, Alicia Rodríguez-Gascón, María ÁngelesSolinís, et al. (2020) Nanomedicines to Deliver mRNA: State of the Artand Future Perspectives. Nanomaterials 10(2): 364.
- Richter AW, Akerblom E (1984) Polyethylene glycol reactive antibodiesin man: titer distribution in allergic patients treated with monomethoxypolyethylene glicol modified allergens or placebo, and in healthy blooddonors. Int Arch Allergy Appl Immunol 74(1): 36-39.
- Tian L, Kim M, Li H, Wang J, Yang W, et al. (2018) Structure of HIV-1reverse transcriptase cleaving RNA in an RNA/DNA hybrid. PNAS115(3): 507-512.
- Hu W, Hughes S (2012) HIV-1 Reverse Transcription. Cold Spring HarbPerspect Med 2(10): a006882.
- Dharan A, Bachmann N, Talley S. Virginia Zwikelmaier, Edward M.Campbell, et al. (2020) Nuclear pore blockade reveals that HIV- completes reverse transcription and uncoating in the nucleus. NatMicrobiol 5: 1088-1085.
- Selyutina A, Persaud M, Lee K, Kewa V, Diaz F, et al. (2020) NuclearImport of the HIV-1 Core Precedes Reverse Transcription and Uncoating.Cell press 32(13): 108201.
- Cartier R, Reszka R (2002) Utilization of synthetic peptides containingnuclear localization signals for nonviral gene transfer systems. GeneTherapy 9(3): 157-167.
- Christ F, Thys W, De Rijk J, Gijsbers R, Albanese A, et al. (2008)Transportin-SR2 imports HIV into the nucleus. Curr Biol 18(16): 1192-1202.
- Luban J (2008) HIV-1 infection: going nuclear with TNPO3/Transportin-SR2 and integrase. Curr biol 18(16): R710-713.
- Yakubov LA, Deeva EA, Zarytova VF, Ivanova EM, Ryte AS, et al. (1989)Mechanisms of oligonucleotide uptake by cells: Involvement of specificreceptors? Proc Natl Acad Sci 86(17): 6454-6458.
- Lee YN, Bieniasz PD (2007) Reconstitution of an infectious humanendogenous retrovirus. PLoS Pathog 3.
- Kitamura Y, Ayukawa T, Ishikawa T, Kanda T, Yoshiike K, et al. (1996)Human endogenous retrovirus K10 encodes a functional integrase. JVirol 70: 3302-3306.
- Dewannieux M, Harper F, Richaud A, Letzelter C, Ribet D, et al. (2006)Identification of an infectious progenitor for the multiple-copy HERV-Khuman endogenous retroelements. Genome Res 16(12): 1548-1556.
- Dewannieux M, Ribet D, Heidmann T (2010) Risks linked to endogenousretroviruses for vaccine production: a general overview. Biologicals38(3): 366-370.
- Belshaw R, Dawson AL, Woolven-AUen J, ReddingJ, Burt A, et al. (2005)Genome wide screening reveals high levels of insertional polymorphismin the human endogenous retrovirus family HERV-K(HML2):Implications for present-day activity. J Virol 79: 12507-12514.
- Victoria JG, Wang C, Jones MS, Jaing C, McLoughlin K, et al. (2010) Viralnucleic acids in live-attenuated vaccines: detection of minority variantsand an adventitious virus. J Virol 84: 6033-6040.
- Brady T, Lee YN, Ronen K, Malani N, Berry CC, et al. (2009) Integrationtarget site selection by a resurrected human endogenous retrovirus.Genes Dev 23(5): 633-642.
- Jarzyna P, Doan N, Deisher T (2016) Insertional mutagenesis andautoimmunity induced disease caused by human fetal and retroviralresidual toxins in vaccines. Issues in Law & Medicine 31(2): 221-234.
- Hacein-Bey-Abina S, Garrigue A, Wang GP, Soulier J, Lim A, et al. (2008)Insertional oncogenesis in 4 patients after retrovirus-mediated genetherapy of SCID-X1. J Clin Invest 118(9): 3132-3142.
- Vargas D, Raj A, Marras S, Kramer F, Tyagi S, et al. (2005) Mechanismof mRNA transport in the nucleus. PNAS 2005, 102(47): 17008-17013.
- Gladyshev E, Arkhipova I (2011) A widespread class of reversetranscriptase-related cellular genes. PNAS 108(51): 20311-20316.
- Spadafora C (2008) A Reverse transcriptase-dependent mechanismplays central roles in fundamental biological processes. Syst Biol ReprodMed 54(1): 11-21.
- Sciamanna I, Landriscina M, Pittoggi C, Quirino M, Mearelli C, et al.(2005) Inhibition of endogenous reverse transcriptase antagonizeshuman tumor growth. Oncogene 24: 3923-3931.
- Zhang L, Richards A, Khalil A, Wogram E, Ma H, et al. (2020) SARS-CoV-2RNA reverse-transcribed and 1 integrated into the human genome.
- https://articles.mercola.com/sites/articles/archive/2021/02/10/nanoparticles-in-moderna-vaccine.aspx
- Nicholson A (1999) Function, mechanism and regulation of bacterialribonucleases. FEMS Microbiol Rev 23(3): 371-390.
- Durbin A, Wang C, Marcotrigiano J, Gehrke L (2016) RNAs ContainingModified Nucleotides Fail to Trigger RIG-I Conformational Changes forInnate Immune Signaling. Bio 7(5): e00833-00816.
- Syitkin Y, Cheng Y, Chackraborty T, Presnvak V, John M, et al. (2017) N1-methyl-pseudouridine in mRNA enhances translation through eIF2α-dependent and independent mechanisms by increasing ribosomedensity. Nucleic Acid Res 45(10): 6023-6036.
- https://montoliu.naukas.com/2020/12/27/la-ciencia-que-hay-detrasde-la-primera-vacuna-contra-la-covid-19/
- Grunwitz C, Krantz L (2017) mRNA Cancer vaccines-messages thatprevail. Curr Top Microbiol Immunol 405: 145-164.
- https://www.euroweeklynews.com/2021/01/15/huge-outbreak-inbenidorm-nursing-home-after-covid-jab/
- h t t p s : / / w w w. b b c . c o m / n e ws / u k- s c o t l a n d - e d i n b u rgh - e a s t -fife-55962427
- Anderson RM, Heesterbeek H, Klinkenberg D, Hollingsworth TD (2020)How will country-based mitigation measures influence




Comentarios del Lector
a nuestro Boletín