Se suma así a la lista de dependencias de otras sustancias (glucosa, glutamina, metionina, etc) que deberían explotarse clínicamente con terapias dirigidas a incidir en esos puntos de presión, pero que NO se aplican.
Este artículo es un breve extracto del tomo III de la Enciclopedia del cáncer, dedicado el metabolismo tumoral y este profundo análisis conceptual me servirá para establecer medidas de orden práctico, con la ayuda de la red que construiré en Oncología Metabólica.
El hierro: tan imprescindible como peligroso
El hierro es indispensable, al participar como cofactor de numerosas proteínas, incluyendo muchas enzimas. De esa forma interviene en numerosas funciones: no sólo en la oxigenación al formar parte de la hemoglobina, sino en el metabolismo del oxígeno en peroxidasas, en la respiración celular y en la cadena de transporte de electrones en los citocromos, en la detoxificación formando parte del citocromo P450 o en la defensa antioxidante formando parte de catalasas.
Otras proteínas que contienen hierro no-heme intervienen en la síntesis de ADN, en la proliferación y diferenciación celular, en la regulación genética, la síntesis de hormonas esteroideas, en la defensa inmune (mieloperoxidasas), etc.
El hierro constituye un elemento esencial en el equilibrio redox debido a su habilidad para pasar cíclicamente por dos estados de oxidación: ferroso (Fe2+) o férrico (Fe3+), habilidad que comparte con otros metales como cobre o manganeso. Por lo tanto, el hierro puede ejercer funciones de catalizador de reacciones oxidativas y reductivas, al aceptar o donar electrones (estudio).
En los organismos anaerobios la adquisición de hierro soluble en forma ferrosa no representaba un serio problema, pero en los aerobios sí: el oxígeno oxida la forma ferrosa a férrica, que es insoluble en el plasma en pH fisiológicos, y el ciclo de oxidación en presencia de H2O2 y O2-, producidos en abundancia durante la respiración oxidativa y las reacciones enzimáticas, conduce a una reacción Fenton, que produce peligrosos radicales hidroxilo (OH-) que pueden dañar la estructura celular (estudio). Hablaremos más extensamente de su aplicación concreta en el apartado dedicado a las acciones prácticas.
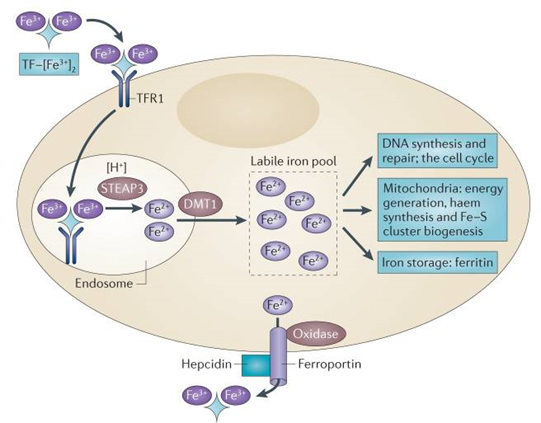
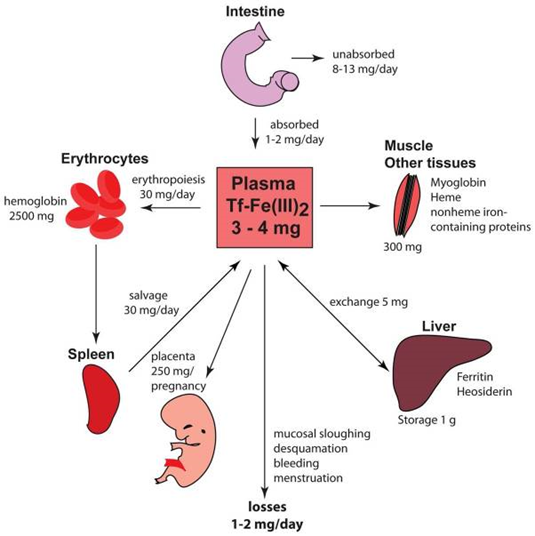
La insolubilidad del hierro oxidado y su toxicidad son un problema para los organismos aerobios, de ahí que disponga de múltiples estrategias para manejar las reservas de hierro uniéndola con proteínas y así mantener los niveles de hierro libre en estrechos márgenes homeostáticos: ya hemos visto que la mayoría del hierro se almacena de forma intracelular, unido a ferritina, a la espera de ser utilizado por la célula o en los eritrocitos con el fin de sintetizar hemoglobina funcional. Para su transporte por el plasma, el poco hierro extracelular se une a una molécula llamada transferrina. Es decir, en cada escenario el hierro forma parte de diferentes proteínas para controlar su toxicidad.
La hepcidina es un péptido sintetizado en el hígado que se considera actualmente la principal hormona reguladora de la homeostasis del hierro. Su nombre procede de su procedencia hepática (hep-) y de su capacidad antimicrobiana (-cidin).
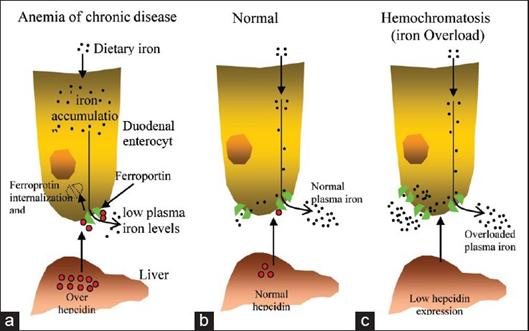
Para describir las funciones de la hepcidina, antes debemos comprender los de la ferroportina, proteína localizada en la membrana celular de enterocitos, macrófagos y hepatocitos y que expulsa el hierro intracelular para ser transportado en el plasma por la transferrina.
Los enterocitos absorben el hierro, los macrófagos lo reciclan a partir de los eritrocitos senescentes y los hepatocitos lo almacenan. Son los mecanismos que controlan la entrada, almacenamiento y reaprovechamiento de adecuadas reservas de hierro, que deben estar listas para ser entregadas a los eritrocitos con el objetivo de que funcione apropiadamente la hemoglobina.
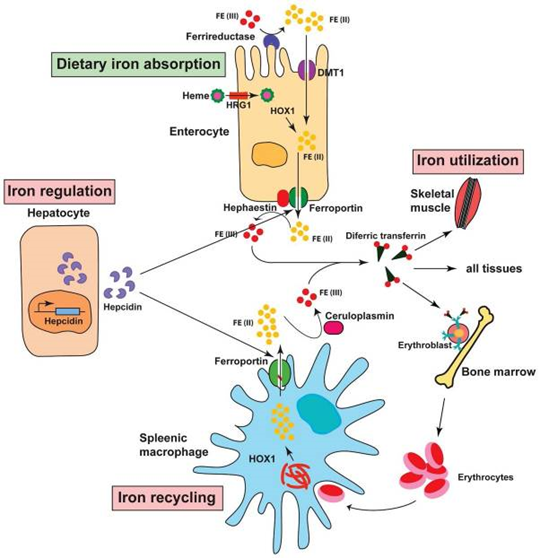
Las infecciones y la inflamación (que sobreexpresa citoquinas como la IL-6) producen una elevación de la síntesis de hepcidina, lo cual conlleva un decremento en la absorción, reutilización y almacenamiento del hierro, y su escasa disponibilidad en los glóbulos rojos, lo cual puede conducir a la anemia. Eso sucede porque muchos microorganismos acaparan hierro y el organismo decide no facilitarles la tarea (estudio).
Alteraciones como la hemocromatosis o la talasemia conducen a una deficiencia de hepcidina que produce el fenómeno opuesto: un incremento de la absorción, reciclaje y almacenamiento de hierro y, debido a la sobreproducción relativa de ferroportina, un incremento del hierro plasmático (estudio).
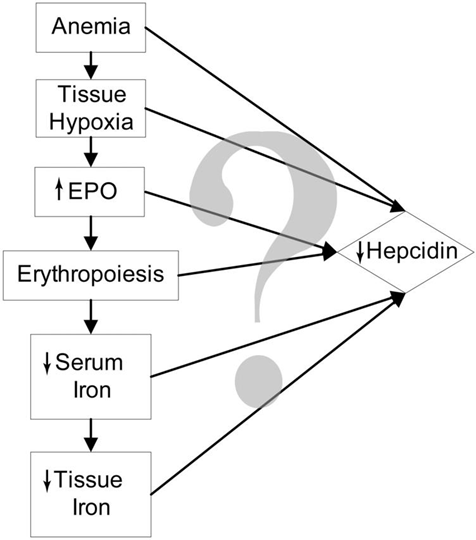
La hipoxia y la anemia (sea ferropénica o por otras causas) también conducen a una deficiencia de la producción de hepcidina, para que el organismo reponga las reservas de glóbulos rojos y mejore la oxigenación incrementando la eritropoyesis.
Para que la hemoglobina de los nuevos glóbulos rojos sea funcional se necesita que los almacenes de hierro celulares estén disponibles, porque la absorción dietética diaria no sería suficiente, y por eso se inhibe la producción de hepcidina, que a su vez deja libre a la ferroportina para que exporte el hierro intracelular. Eso explica que las acciones que estimulan una deficiente eritropoyesis conducen habitualmente a una sobrecarga de hierro (estudio).
Recordemos estos hechos que regulan al alta o a la baja la hepcidina, porque los usaremos más adelante para deducir posibles medidas que afecten al desarrollo tumoral basadas en el metabolismo alterado del hierro.
No sólo se produce un control sistémico hepático de la hepcidina, sino que algunos órganos podrían ejercer controles locales. Tal parece ser el caso del corazón (estudio).
Estudiar las funciones intracelulares del hierro y encontrar nuevas diferencias cuantitativas y cualitativas entre las células sanas y las neoplásicas nos permitirá deducir acciones terapéuticas.
El hierro y sus derivados (como el hierro heme o los clusters hierro-azufre) son esenciales para la función de enzimas productoras de ROS (NADPH, NOXs, LOX, enzimas citocromo P450, subunidades de la cadena de transporte de electrones, etc). También forma parte de la enzima catalasa, destructora de peróxido de hidrógeno. Pequeños pools de moléculas de hierro residen en el citosol y en la mitocondria, que puede considerarse enriquecida en hierro, y su acumulación excesiva podría derivar en reacciones Fenton muy dañinas para la estructura celular. El hierro es imprescindile para la generación de ROS que, a niveles moderados, actúan como señalizadores celulares, pero su exceso puede conducir a la muerte celular (estudio). Por esa razón el exceso de hierro intracelular (asociado o no a un desequilibrio redox) correlaciona con numerosas dolencias.
El metabolismo del hierro, tanto en el citoplasma como en la mitocondria, es muy complejo (estudio), así que nos enfocaremos un poco más adelante en el estudio directo de las diferencias entre las células sanas y tumorales.
Hierro y sistema inmune
La regulación de los niveles de hierro constituye además un primer mecanismo de defensa inmunitaria y frente a patógenos: la mayoría del hierro se encuentra contenido en la hemoglobina, y su metabolismo está finamente regulado. El metabolismo de numerosos patógenos requiere la presencia de altas cantidades de hierro (estudio), y algunos microbios han evolucionado para liberar la hemoglobina atacando a los eritrocitos.
Hongos como la Cándida, protozoos como la Leishmania, bacterias gram-positivas como la Listeria, bacterias gram-negativas como la Legionella y virus como el citomegalovirus prosperan en ambientes con un exceso de hierro (tabla). Más adelante comprobaremos que existen correlaciones entre cáncer y crecimiento local de ciertos microbios, y tal vez el hierro sea uno de los nexos comunes en ambos hechos concurrentes.
Una de las primeras líneas de defensa de activación inmunitaria más efectiva es el secuestro de nutrientes, para privar de ellos a los patógenos, y el hierro es uno de los principales (estudio). Los macrófagos son los principales controladores de la homeostasis del hierro plasmático, al reciclar los eritrocitos defectuosos y envejecidos, e impedir que los microbios utilicen el exceso de hierro que quedaría disponible (estudio), pero un exceso de hierro también puede provocar una sobrecarga y mal funcionamiento de los macrófagos (estudio).
Al acaparar hierro los macrófagos, y pasar a ser la mayoría del hierro intracelular, asociado a ferritina o hemoglobina, el disponible en el plasma para el sobrecrecimiento microbiano es mínimo.
En los estrechos niveles de pH a los que se mantiene la sangre y en el ambiente aerobio del plasma, el hierro extracelular se mantiene insoluble y se dificulta su disponibilidad para los patógenos. Además, la transferrina actúa rápido para unirse al poco hierro libre sanguíneo disponible.
La importancia del mantenimiento de niveles adecuados de hierro (suficientes para asegurar cantidad óptima de hemoglobina y funciones celulares, pero no tantos como para que el hierro plasmático e intracelular sea excesivo) se refleja en la mayor susceptibilidad a las infecciones típica de pacientes de talasemia y hemocromatosis, dos de las afecciones genéticas más usuales.
La hemocromatosis se caracteriza por la presencia de elevados niveles crónicos de hierro, que obligan a los pacientes a la realización de frecuentes flebotomías, y es habitual su asociación con mayor riesgo de infección (estudio). El exceso de hierro sobrecarga a los macrófagos, dificulta la acción de los neutrófilos, inhibe la acción bactericida de los leucocitos, dificulta la síntesis de inmunoglobulinas y hace que haya más probabilidades de que las bacterias lo utilicen para prosperar (estudio).
Otras enfermedades que producen liberación de hierro desde los almacenes celulares de ferritina, como la hepatitis, o que conducen a una liberación de hierro desde la hemoglobina de los eritrocitos, como la porfiria, la talasemia, o algunas leucemias, también se asocian a infecciones más frecuentes.
Pero los niveles deficitarios de hierro también conducen a problemas inmunitarios, sobre todo impidiendo la capacidad fagocítica de los macrófagos, disminuyendo la capacidad de las Natural Killer, de los linfocitos y de los neutrofilos (estudio, estudio).
En el caso del cáncer comprobaremos que es habitual la combinación explosiva entre neoplasias inundadas localmente de hierro y un organismo huésped vaciado sistémicamente de sus reservas de hierro, lo cual conlleva un doble problema.
La hepcidina, por su parte, es conocida por su capacidad antimicrobial y se considera también un mecanismo de defensa inmune (estudio).
Problemas del exceso de hierro. Ferroptosis
La anemia ferropénica dificulta la correcta oxigenación tisular, pero el exceso de hierro puede ser un problema incluso mayor. Hay una fuerte asociación entre niveles de hierro sanguíneo y múltiples dolencias, sobre todo en hombres, quizás debido a que las mujeres sufren pérdidas menstruales de sangre que mantienen los niveles de hierro en niveles aceptables.
El riesgo de anemia en mujeres jóvenes es mayor que en hombres, aunque ambos comienzan a igualarse tras la menopausia, que frena la pérdida de sangre.
El hierro es un metal imprescindible, pero potencialmente dañino en cuanto sobrepasa ciertos niveles. Es probable que durante muchos miles de años las duras condiciones de vida produjeran habituales pérdidas de sangre que mantuvieran a raya los niveles de hierro, pero la comodidad que la tecnología nos ha proporcionado no ha venido acompañada de una adaptación orgánica similar: estamos diseñados para almacenar hierro. El hierro se elimina con dificultad y tiende a acumularse y las consecuencias de este hecho pueden acarrear problemas de toda índole. Tal vez por esa razón las sangrías hayan sido práctica habitual durante centenares de años. Marcos Vázquez, de Fitness Revolucionario ha escrito un artículo que trata el tema en profundidad (artículo).
La combinación de disponibilidad de hierro al exponernos a alimentos fortificados y la ausencia de sangrados habituales, sobre todo en hombres, combinados con la eliminación de factores que tienden a mantener los niveles de hierro a raya (ejercicio físico, quelantes en forma de polifenoles y especias) han traído como consecuencia niveles de hierro que correlacionan con numerosas enfermedades (estudio).
- Elevados niveles de ferritina (una de las formas más sencillas y fiables de medir los niveles de hierro, aunque no es del todo precisa) correlacionan con mayores riesgos de desarrollo de diabetes (estudio).
- Correlación entre niveles de ferritina y mayor acumulación de grasa visceral y subcutánea (estudio).
- Asociación entre niveles desequilibrados de iones hierro, cobre y zinc y enfermedad de Alzheimer y papel neuroprotector de quelantes del hierro (estudio).
- Relación directa entre riesgo de mortalidad por cualquier causa y niveles de ferritina que llevan a los autores de este estudio a titularlo: "Enfermedad ferrotóxica: el siguiente gran reto de la salud" (estudio).
- Ratio bajo magnesio/hierro, relacionado con peor control de glucosa en ayunas en adultos (estudio).
La ferroptosis es un tipo de muerte celular bioquímica, morfológica y genéticamente diferente de otros tipos y que depende exclusivamente del hierro intracelular. El exceso de hierro produciría un desequilibrio en el balance redox: se desencadenaría una reacción Fenton que conduce a la peroxidación de las membranas lipídicas y podría ocasionar la muerte celular, aunque, como siempre que hablamos de este tema, ese sacrificio individual puede implicar la supervivencia colectiva del tejido donde se inscribe.
Es un mecanismo útil cuando está equilibrado: su exceso puede conducir a enfermedades neurodegenerativas, pero también puede ser una potente herramienta antitumoral si está limitado a la localidad neoplásica (aunque hay matices). Por eso analizaremos cómo usarla contra el cáncer.
Se ha descubierto que la inhibición de la ferroptosis también inhibe la muerte producida por un exceso de glutamato, al actuar sobre el antiporte cistina/glutamato.
Fármacos como Erastin conducen a una acumulación de hierro en la célula y también a una deprivación de cisteína mitocondrial, lo cual dificulta la creación de glutatión, desequilibra el balance redox y potencia la ferroptosis. De hecho, el nivel de cisteína parece ser la clave conceptual de la ferroptosis (estudio).
Muchos estudios consideran que la ferroptosis alberga menos contradicciones conceptuales que la autofagia y que, en el caso del cáncer, constituye un fenómeno supresor tumoral. En ese caso sería un arma que deberíamos explotar terapéuticamente (estudio).
Pero, como era de esperar, las cosas no son tan sencillas y debemos añadir el necesario matiz: en realidad la ferroptosis podría considerarse un tipo de muerte similar a la que corrrelaciona con autofagia, por cuanto intervienen en ella los lisosomas, e incluso erastin parece conducir también a la apoptosis, dejando entrever las similitudes o solapamientos desconocidos que existen entre los diferentes tipos de muerte celular (estudio, estudio).
La ferroptosis tumoral parece actuar gracias a los canales mitocondriales dependientes del voltaje (VDACs), de los que hablaré en el libro dedicado a la biofísica. Aunque no está clara la participación indispensable de la mitocondria en la ferroptosis, hay señales de que esta sólo se produce cuando hay mitocondrias disfuncionales. De ser así, los tumores serían especialmente sensibles al tratamiento que busque inducir ferroptosis, aunque recordemos que no es segura la disfunción mitocondrial en el cáncer. Es muy probable que exista, pero no está claro ni su alcance ni las funciones mitocondriales implicadas en dicho daño.
Debido al papel que la glutamina, no sólo la cisteína, tiene en la defensa antioxidante, el bloqueo de la glutaminólisis tumoral (que analizo profundamente también en el libro) potenciará a su vez la ferroptosis, así que debemos tener en cuenta esa potencial sinergia cuando analicemos las medidas prácticas.
La glutatión peroxidasa 4 (GPX4) es el principal regulador de la ferroptosis, y anularla impulsa la ferroptosis. Pero debe intentar limitarse al tumor, porque podría ser dañino para otros órganos.
Existen otras interacciones, como la que se produce entre el metabolismo de los lípidos y la ferroptosis, lógico por cuanto la ferroptosis implica una peroxidación lipídica. Pero hay lípidos más susceptibles que otros a esa peroxidación: las membranas compuestas por lípidos más saturados resisten mejor que las que basan su estructura en ácidos grasos poliinsaturados (lo mismo que sucede con los aceites a la hora de freír alimentos: el aceite de girasol, por ejemplo, es menos estable que el sebo o la mantequilla) (estudio).
Otros dos 'puntos de presión' que hacen sinergia y que tengo en cuenta cuando analizo en profundidad en el libro el importantísimo asunto del anabolismo tumoral de lípidos.
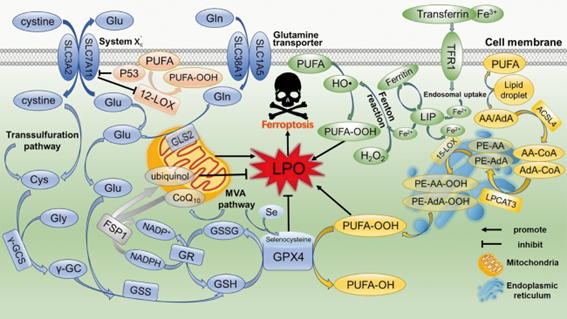
Hay algunas desventajas también: aunque, como ya hemos analizado previamente, el glutatión es, con diferencia, el principal antioxidante que contrarresta la sobreproducción de ROS, con lo cual impedir la correcta síntesis de GSH intracelular en el tumor es una acción terapéutica muy eficaz, otros antioxidantes podrían contrarrestar la ferroptosis hasta cierto punto, pese a que, como veremos en el apartado práctico, son también medidas antitumorales, aunque por otras vías. Por ejemplo selenio, ubiquinol o vitamina E (estudio).
Otras moléculas como estatinas o inhibidores de autofagia como cloroquina podrían también frenar la ferroptosis.
Es un baile sutil entre medidas sinérgicas y antagónicas, lo cual confirma que tendremos que diseñar varias estrategias combinadas que se aplicarán de forma sucesiva, no confluyente (estudio). El tema del hierro es uno de los más complejos debido a ello: por cada molécula analizada tendremos que discernir si potencia, inhibe o es inocua respecto de la ferroptosis.
Hierro, anemia y cáncer
Como siempre, debemos recordar que, por mucho que todavía se afirme que numerosos cánceres suceden por una cuestión de "suerte", y que unos "genes" deciden mutar, una neoplasia no es un motor "que gira en vacío". No es una realidad caprichosa de la naturaleza.
Su contexto es un organismo que probablemente ha colaborado con el inicio y el avance de la patología local debido a alteraciones que sólo vislumbramos (y de las cuales he hablado y hablaré a lo largo de los libros). Tanto el inicio del cáncer como su desarrollo implican cambios en el organismo y en ese conjunto de células y proteínas llamado microambiente. En esa doble realidad, local y sistémica, debemos movernos constantemente, porque el entorno condiciona al tumor, pero el tumor puede también condicionar al entorno, de ahí que debamos diferenciar entre 2 realidades:
- Cambios sistémicos que podrían haber conducido a una neoplasia, es decir, cambios orgánicos que son causas potenciales.
- Condiciones locales del tumor que, al avanzar, conducen a cambios sistémicos que son consecuencias de la progresión tumoral pero que, a su vez, pueden facilitar el avance tumoral y convertirse en nuevas causas.
Comprobaremos:
- Que el exceso de hierro tal vez pueda iniciar o favorecer el desarrollo de un cáncer.
- Que la anemia, de cualquier clase: por deficiencias de hierro (es decir, el fenómeno inverso al punto anterior), de vitamina B12, de folato o de factores intrínsecos tal vez pueda conducir también a la carcinogénesis, por otros caminos.
- Que el cáncer acumula hierro para mantener su metabolismo exagerado, pero se protege adecuadamente del desequilibrio en el balance redox y la ferroptosis que induciría en células sanas.
- Que su avance vacía las reservas de hierro del organismo, induciendo una anemia sistémica y que ésta a su vez favorece el avance del tumor al exacerbar la hipoxia, construyendo un círculo vicioso de gran peligro.
Aunque los datos epidemiológicos no constituyen una pistola humeante, ni podemos usarlos para la determinación de la influencia de variables aisladas, algunos estudios apuntan en la dirección de un posible papel carcinogénico del exceso de hierro, y son coherentes con otras enfermedades metabólicas cuya relación con dicho exceso sí parece más sólida y a las que nos hemos referido en un apartado anterior (estudio).
El papel del exceso de hierro como productor de ROS que desequilibran el balance redox está bien establecido y ya hemos propuesto en un apartado anterior del libro una hipótesis razonable que podía explicar el inicio de la carcinogénesis a partir del daño inducido por un exceso de radicales libres, bien en la estructura de la membrana celular o bien en la mitocondrial, con la cardiolipina como principal implicada.
Algunos estudios proponen que el cáncer (para ser más precisos deberíamos hablar de la etiología de algunos cánceres) sea una enfermedad inducida por una toxicidad del hierro.
Una teoría que se apoya por el hecho de que las flebotomías y las donaciones de sangre correlacionan con menor riesgo de padecer la enfermedad (estudio) y que los enfermos de hemocromatosis hereditaria presentan un riesgo considerablemente mayor de padecer algunos tipos de cáncer, sobre todo de hígado (estudio).
Anemia y riesgo de cáncer
Más adelante veremos que el avance del cáncer conduce con frecuencia a una anemia ferropénica, pero no tan clara es la posible relación causal entre anemia previa y el inicio de la carcinogénesis. Como siempre, causas y consecuencias se entremezclan cuando analizamos el cáncer.
De nuevo, los estudios epidemiológicos y observacionales deben ser tomados con escepticismo, pero sí debemos considerar las potenciales correlaciones que establecen. En un estudio elaborado en Taiwan, se encontró una correlación directa significativa entre la anemia crónica y un mayor riesgo de múltiples tipos de cáncer. El estudio tuvo en cuenta que el cáncer puede ser un causante de anemia, para evitar confundir causas con consecuencias. Incluso tras el efecto corrector de ese hecho siguió encontrándose una relación directa significativa (estudio).
La explicación no contradice la anterior hipótesis que relacionaba el cáncer con un exceso de hierro, sino que apuntala la teoría de las causas múltiples, concurrentes o no, que conducen a un escenario común de carcinogénesis. Si en el caso del exceso de hierro la carcinogénesis podía ser explicada por un desequilibrio redox, en este caso puede explicarse por una 'crisis respiratoria', una hipoxia tisular crónica que conduciría (sobre todo si se asocia con una incapacidad mitocondrial por otras causas) a un mayor protagonismo de la fermentación sobre la oxidación, con el peligro de proliferación que ese hecho conlleva.
Estas explicaciones también acorralan a la antigua teoría del cáncer como suceso 'genético' y confiado al 'azar': argumento vergonzoso, deshonesto y perezoso, que reconoce con impotencia su ignorancia e incapacidad de dotar al discurso de mayor rigor intelectual.
***
En el siguiente artículo de la serie nos enfocaremos específicamente en el papel del hierro en una neoplasia ya iniciada, lo que nos servirá para deducir potenciales medidas prácticas.






Comentarios del Lector
a nuestro Boletín