Este artículo es un breve extracto del tomo III de la Enciclopedia del cáncer, dedicado el metabolismo tumoral.
Es un artículo bastante técnico, pero necesito profundizar tanto para comprender qué "puntos de presión" podremos pulsar con acciones prácticas, que luego aplicaremos entre todos en la red de Oncología Metabólica.
El hierro en el microentorno y en la célula tumoral
Independientemente de los hechos que conducen a la carcinogénesis y que probablemente nunca puedan dilucidarse del todo, tenemos mucha más información de lo que sucede una vez que el cáncer se ha establecido, y el hierro aporta un nuevo hecho diferencial en la biología de la célula tumoral respecto de las sanas.
Es un hecho bien establecido que la célula tumoral incrementa su almacenaje de hierro, tal vez como cofactor en las reacciones enzimáticas sobreexpresadas de sus células en proliferación. Las células incrementan la expresión de receptores de transferrina (TfR1 y TfR2), sintetizan o segregan ferritina y parecen influir en la sobreexpresión de hepcidina hepática del huésped (estudio).
La transferrina (Tf) es un factor de crecimiento en todo tipo de células proliferativas (sólo parecen haberse encontrado tales receptores en células que se dividen: estudio), al captar hierro del plasma y entregarlo a la célula. En numerosos estudios se ha comprobado que la transferrina puede sustituir a los factores de crecimiento. Hay una correlación entre cantidad de receptores de transferrina (CD71) en la célula tumoral y agresividad y resistencia a la quimioterapia (estudio).
La sobreexpresión de los ya mencionados receptores de transferrina en la célula tumoral es lo suficientemente elevada en comparación a los de las células sanas como para poder ser utilizado como objetivo terapéutico, de dos formas: bien como medio para introducir en la célula tumoral moléculas que entreguen otros fármacos, conjugados con la transferrina (estudio) (algunos de ellos atraviesan sin problemas la barrera hematoencefálica y pueden usarse en tumores tradicionalmente más difíciles de alcanzar, como los gliomas: estudio), o bien para bloquear o dificultar la captación de hierro por parte del tumor, lo cual influiría en su capacidad de proliferación.
Por su parte, la ferritina ha adquirido últimamente un papel destacado en el cáncer: no sólo se trata de una proteína que se liga al hierro intracelular, sino que parece ejercer otras funciones extracelulares. Sus niveles en el plasma de enfermos de cáncer suelen estar elevados y correlacionan con mayor agresividad de la enfermedad y peor pronóstico. Los macrófagos asociados al tumor (TAM) presentan igualmente altos niveles de ferritina (estudio).
Hay dos tipos de subunidades de ferritina: la L y la H. Se han detectado niveles significativamente más altos de ferritina en condiciones diversas como cirrosis. La ferritina sanguínea contiene muy poco hierro en comparación con, por ejemplo, la ferritina hepática (entre un 4% y un 20% de esa cantidad) incluso en pacientes con sobrecarga de hierro.
A pesar de ello, los niveles de ferritina en suero correlacionan de forma bastante ajustada con la cantidad de hierro almacenado y disponible: son bastante más bajos en pacientes de anemia ferropénica o sometidos a flebotomías y más altos en pacientes sometidos a sobrecarga de hierro o hemocromatosis. No obstante, la elevación plasmática en inflamación o en cáncer debe ser ajustada con la medición de la saturación de transferrina en ayunas, para descartar sobrecarga de hierro. Puede que la elevación de ferritina no correlacione, en esos casos, con exceso de hierro. De hecho, los enfermos de cáncer, como veremos a continuación, pueden presentar anemia debido a la escasa disponibilidad de hierro por parte de la hemoglobina de los eritrocitos.
La cantidad de ferritina correlaciona positivamente con la edad, el índice de masa corporal, el sexo (menor en mujeres, seguramente debido a las pérdidas periódicas de sangre menstrual), suplementación e ingesta de hierro heme y correlaciona negativamente con el ejercicio físico y la toma de aspirina. También se eleva durante los períodos de inflamación aguda y correlaciona con los de la proteína C reactiva.
La fuente de la ferritina plasmática no está del todo clara (estudio), pero parece proceder de hepatocitos, macrófagos y microglía. Probablemente sean los macrófagos la fuente más abundante, y tanto el fenotipo como la cantidad de macrófagos asociados al tumor como la microglía participan activamente en el avance tumoral, quizás debido a que sus capacidades están mediadas por los niveles de ferritina y su capacidad de utilización del hierro.
La mayoría de los tejidos neoplásicos presentan elevados niveles de ferritina (además de elevarse en el plasma del enfermo) y los ratios entre las subunidades L y H son diferentes, aunque parecen haberse encontrado sobre todo en el tejido conectivo del estroma tumoral y en los histiocitos que rodean a las células tumorales y permanece en niveles relativamente bajos (más bajos que en el tejido sano) en las células epiteliales del tumor (estudio) (como curiosidad, en este mismo estudio sólo se encontró lactoferrina en el tejido sano y en menor medida en carcinomas benignos, pero no en el tejido neoplásico más agresivo. Recordemos que estudiamos ya la lactoferrina por su capacidad antitumoral en el libro dedicado a la microbiota).
Los estudios confirman que el nivel de hierro de las células tumorales se mantiene bajo, más aún conforme el tumor progresa, lo cual es hasta cierto punto paradójico, debido al alto consumo de hierro en el tejido neoplásico. Si a esto le añadimos la sobreexpresión de transferrina, que importa hierro dentro de las células y la menor expresión de ferroportina, que exporta el hierro fuera de la célula, concluimos que quizá la explicación es que hay un elevado uso del hierro intracelular con mínima exportación al espacio extracelular pero también con mínimo almacenaje para el futuro. Es decir: el hierro se usa inmediatamente por la célula tumoral.
Pero el hierro en el estroma sí está elevado y parece estar relacionado, como ya hemos comentado, con los macrófagos asociados al tumor, y de nuevo resaltamos la importancia capital que adquieren en la progresión del cáncer y confirman que el hierro y todas las proteínas asociadas a su transporte son objetivos terapéuticos de primer orden (estudio).
Este hecho nos recuerda además la importancia de actuar sobre el estroma tumoral y no enfocarnos exclusivamente en las células epiteliales neoplásicas: el microentorno sostiene su crecimiento como 'guardaespalda' y 'niñera'. Abordo en los libros un profundo y detallado análisis del estroma asociado al tumor.
La compleja relación de los macrófagos con el hierro podría incluso constituir la base de otra hipótesis de posible inicio de la carcinogénesis. Ya hemos visto que los macrófagos (polarizados en su fenotipo clásico, M1) secuestran el exceso de hierro para impedir su aprovechamiento por parte de los microbios, sobreexpresando ferritina y equilibrando la expresión de ferroportina y transferrina como exportador/importador del hierro.
La mayoría del hierro se presenta en los mamíferos en forma heme, dentro de un anillo de protoporfirina. Como ya hemos comentado el hierro es imprescindible para la vida al donar o aceptar electrones y formar parte de numerosas proteínas, pero también resulta citotóxico de forma libre, así que su regulación debe ser muy precisa. Los macrófagos juegan en ese control un papel determinante (estudio).
Cada fenotipo de macrófagos interacciona de forma opuesta con el hierro y contribuye al control de sus características a favor de la proliferación o de la muerte celular. No es extraño que su desequilibrio y la incoherencia de un exceso de cada fenotipo en determinadas situaciones conduzca a diferentes problemas: por ejemplo, un exceso de fenotipo M2 en cáncer o un exceso de M1 en daños tisulares. Por su parte el hierro también modula, de forma bidireccional, el fenotipo de los macrófagos (estudio).
Hemos explicado en varias ocasiones que los macrófagos ejercen tareas diversas en función de las condiciones del entorno del tejido donde residen, que los polariza entre dos estados M1 y M2. Aunque no suele ser una polarización binaria, sino que se refleja en forma de un continuo, en cada estado fenotípicamente extremo el macrófago adquiere propiedades que pueden ser totalmente opuestas y que hemos resumido de forma muy esquemática así: el fenotipo M1 ataca amenazas y el M2 repara tejidos.
La inflamación aguda sistémica (inicial durante una infección) induce un estado en el que se elevan los niveles de hepcidina hepática y se degrada la ferroportina, lo que impide el vertido del hierro al plasma para ser distribuido y favorece una acumulación de hierro en los macrófagos, activados de forma clásica (M1), como ya hemos visto, con el fin de que no esté disponible para que prosperen los patógenos. Este estado de acaparación del hierro intracelular, que impide que los eritrocitos obtengan el suficiente para activar la hemoglobina podría explicar las anemias asociadas a infecciones, enfermedades autoinmunes y neoplasias, porque ambas comparten un sistema de "alarma inflamatoria" similar.
Con el desarrollo de la inflamación, durante una etapa posterior, dichos procesos activan el eje hipotálamo-pituitario-adrenal, del que ya hemos hablado, liberando glucocorticoides que facilitan la polarización de los macrófagos a fenotipos M2, dedicados a la reparación de tejidos y eliminación de los restos celulares tras la batalla entre atacantes y sistema inmune.
Es decir, es una etapa en la cual ya se ha eliminado (supuestamente) la amenaza y los macrófagos localizados en las zonas donde se ha plantado 'batalla' se dedican a reparar los desperfectos ocasionados. Como veremos en el apartado dedicado al estroma tumoral, ésa es precisamente la definición de neoplasia: herida que nunca cura.
Una de las mayores diferencias que se establecen entre ambos fenotipos de macrófagos es la referente al metabolismo y la homeostasis del hierro, que es utilizado y tratado de forma sensiblemente distinta según se trate de un M1 o un M2.
En la zona donde se ha establecido la lucha entre atacantes y Sistema Inmune, se incrementa la presencia de hierro heme que procede de la hemoglobina extracelular liberada por la hemólisis de los eritrocitos, característica de la inflamación, los daños tisulares y la sepsis o de la degradación de la catalasa, los citocromos o las peroxidasas procedentes de células muertas.
En respuesta a la presencia de hierro heme y de agentes polarizadores de macrófagos a M2 se produce la expresión de la HO-1 (heme oxidasa-1), que cataliza el hierro heme en 3 productos: bilirrubina (antioxidante), CO (un gas tóxico que presenta también ciertas propiedades beneficiosas al resolver la inflamación) e iones ferrosos en forma libre.
El ión ferroso podría desencadenar un peligroso fenómeno Fenton de oxidación, y parecería lógico que se incrementase la presencia de ferritina que actuase como quelante al unirse a él, pero lo cierto es que eso no sucede. En realidad se sobreexpresa la ferroportina de los macrófagos y se incrementa la liberación de iones ferrosos al entorno extracelular, tal vez para prevenir la muerte de los macrófagos por exceso de hierro, una vez pasada la amenaza de los patógenos.
El hierro liberado puede ser internalizado por endocitosis y usado por las células adyacentes para iniciar el proceso de proliferación y reparación, como se observa en el tejido muscular tras el ejercicio intenso o en la reparación de otro tipo de lesiones, donde los M2 juegan un papel fundamental (estudio).
Los ratones que son deficientes en HO-1 muestran mayor susceptibilidad a la sepsis, estableciendo un papel determinante también para el hierro heme y los 3 productos que derivan de su metabolismo (estudio).
La mayor presencia extracelular de hierro libre podría estimular igualmente la reparación del tejido estromal y la multiplicación de los fibroblastos. Mientras que el proceso normal es necesario para que los tejidos superen cualquier daño que haya podido sufrir, supone también un riesgo, porque el exceso de reparación y crecimiento del tejido estromal anómalo en forma de fibrosis podría desembocar en un cáncer o favorecer el crecimiento de uno ya existente, como analizo en el apartado dedicado al estroma y la matriz extracelular tumoral (estudio).
Parece razonable considerar alguna estrategia terapéutica adicional que no sólo impida la polarización de los macrófagos a M2 en el tumor, sino que limite el hierro disponible en la zona tumoral, o inhiba la HO-1 de forma local (aunque, como siempre, las cosas muy son complejas y requieren extraordinario matiz: la HO-1 está asociada con menor fibrosis, cuya importancia comprenderemos más adelante al estudiar el estroma tumoral. Además, la deficiencia de HO-1 se asocia con mayor transición epitelio-mesenquimal, una característica que facilita las metástasis y que también abordo en los libros) (estudio).
También nos permite comprender las correlaciones que existen entre ciertos procesos infecciosos (y heridas) y la mayor tendencia a desarrollar cáncer en la zona infectada por virus, bacterias, parásitos u hongos: la sobreproducción de M2 y del hierro resultante en el microentorno puede desembocar en un exceso de proliferación y fibrosis, que más adelante explicaremos y que también correlaciona fuertemente con mayor tendencia a una malignización neoplásica.
Igualmente explicaría la presencia constatada en el microentorno tumoral de ciertos virus y hongos, algunos de ellos típicamente asociados con ciertos tumores (como el citomegalovirus con los gliomas): si un tumor es un estado que replica la curación de una herida tras una amenaza, donde los macrófagos no se dedican a atacar ni contrarrestar a los patógenos sino a reparar tejidos, es una zona donde los microbios podrán prosperar, no sólo por la nula vigilancia inmunitaria de los macrófagos sino por la presencia de altas cantidades de hierro libre que pueden usar para expandirse. Trataremos este tema más adelante, pero esta hipótesis será la clave de la explicación.
Por esa razón los tratamientos que eliminen el microbio asociado al tumor también serán antitumorales, tal vez por atacar la parte metabólica común o incidir en la polarización de los macrófagos que sí atacarán tanto a los microbios como al tumor. Y por eso los virus oncolíticos, especializados en atacar a las células cancerígenas se concentrarán en zonas tumorales, repletas de hierro, que usarán para prosperar.
En resumen:
- Los macrófagos polarizados en el fenotipo M1 típico, dedicados a atacar las amenazas externas y exacerbados por la presencia de lipopolisacárido (LPS) o interferón gamma (IFN-γ) -entre otras citoquinas- se caracteriza por altos niveles de ferritina y bajos de ferroportina, lo que provoca que almacene hierro heme intracelularmente, sobre todo asociado a la ferritina y se conserven bajos los niveles de hierro libre. Es decir, importa hierro heme a niveles no muy elevados, pero lo almacena en forma de ferritina y exporta bajas cantidades de hierro libre.
- Inversamente, los macrófagos polarizados en el fenotipo M2, exacerbados por citoquinas como la IL-4, presentan altos niveles de ferroportina y bajos de ferritina, además de altos niveles de la molécula degradativa HO-1. Eso produce una gran entrada de hierro heme, pero una gran degradación de éste en sus 3 metabolitos principales, entre los que se encuentra el ión ferroso, un bajo almacenamiento de hierro en forma de ferritina y una elevada exportación de iones ferrosos al espacio extracelular.
Por esa razón es un remodelador de la matriz extracelular, inmunoregulador, induce a la angiogénesis y la reparación del tejido y es un potente estimulador protumoral.
Se explica de forma esquemática en el siguiente dibujo:
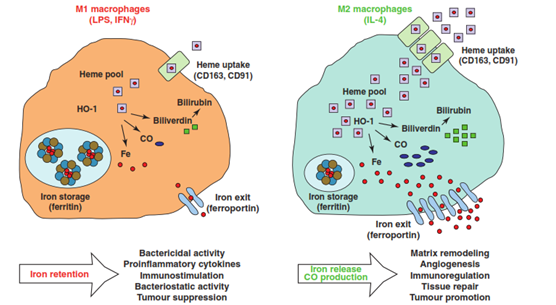
El equilibrio entre fenotipo de macrófagos "que ataca" o M1 y el "que repara" o M2 es fino y ajustado. En el cáncer la balanza se decanta hacia un exceso de reparación (de M2), pero hay otras dolencias, sobre todo aquellas que requieran una cicatrización de tejido dañado, en las que una polarización indeseada hacia M1 exacerba el problema, como sucede cuando hay daños en la médula espinal y un exceso de hierro intracelular polariza a M1 unos macrófagos que serán poco tendentes a reparar el tejido dañado (estudio).
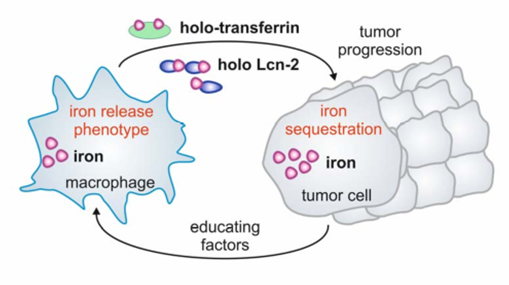
Cómo aprovechan las células propiamente cancerígenas de la masa tumoral ese exceso de hierro libre que los TAM ponen a su disposición
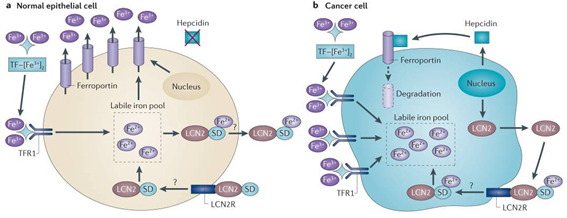
Recordemos que la hepcidina es una hormona hepática que degrada y, por tanto, regula los niveles de ferroportina, que es la encargada de exportar el hierro intracelular hacia el plasma. Se ha encontrado una correlación significativa de niveles elevados de hepcidina en enfermos de diversos cánceres, y mayor cuanto más avanzado sea el estado (estudio, estudio, estudio), lo cual es coherente con los deficientes niveles de ferroportina hallados de forma habitual en las células tumorales (estudio, estudio). Las células cancerígenas parecen ser también capaces de sintetizar hepcidina de forma local, que neutraliza la ferroportina (estudio). Pacientes con elevados niveles de ferroportina y bajos de hepcidina corelacionan con supervivencias excepcionalmente elevadas (estudio).
Este hecho hace que tiendan a incrementarse los niveles de hierro intracelular en las células epiteliales del tumor pero ya hemos visto que, aunque los niveles de ferritina plasmática son elevados en los enfermos de cáncer y también en las células del estroma tumoral, sucede lo contrario en las células tumorales. La ferritina es una proteína que permite almacenar el hierro dentro de la célula, para ser usado más adelante en procesos metabólicos y protege a las estructuras celulares que el daño de un exceso de hierro libre ocasionaría (sobre todo debido al incremento de peroxidación de los lípidos de membrana).
Eso nos indica que el hierro del citoplasma acumulado en la célula tumoral no se almacena, sino que se utiliza activamente en todo tipo de procesos metabólicos en los que ese metal está implicado y que ya hemos señalado sucintamente: las necesidades constantes de hierro se ven por tanto satisfechas gracias a la labor de los ya mencionados TAM, que exportan al medio altas cantidades de ión ferroso.
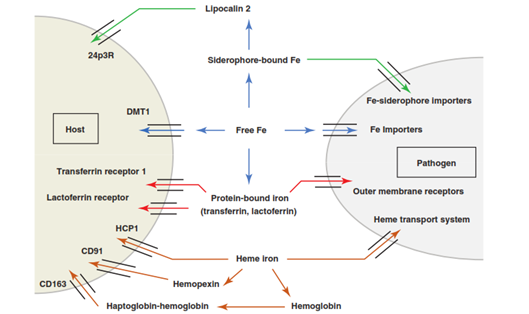
Dicho hierro libre parece ser importado a la célula tumoral gracias a la sobreexpresión de moléculas de transporte diferentes de la transferrina, como la Lipocalina-2 (Lcn-2) (que parece proceder en su mayor parte de neutrófilos asociados al tumor, y que, como analicé en el tomo I, dedicado al sistema inmunitario, ejercen un papel claramente protumoral en el microentorno) (estudio), aunque ya hemos dicho que la transferrina también ejerce su papel de transporte de hierro y los receptores de transferrina están sobreexpresados en la membrana de la célula tumoral.
Además, la célula tumoral parece 'reclamar' a los macrófagos asociados que la provean de hierro mediante la secreción de factores estimuladores que 'educan' a los TAM.
El hierro secuestrado por la célula se internaliza en un endosoma; el que vaya a almacenarse se une a ferritina y el resto se reparte a diferentes partes de la célula incluyendo la mitocondria, donde ejerce variadas funciones (que ya hemos comentado) al formar parte de numerosas proteínas y enzimas que se sobreexpresan en el cáncer, sometido a altas tasas de expansión y anabolismo. La depleción de hierro en los estudios in vitro conduce invariablemente a una menor velocidad de proliferación en las células tumorales y las dietas bajas en hierro consiguen que los tumores en ratones crezcan con menor rapidez (estudio). No es extraño que, de entre las múltiples definiciones que se aplican al cáncer, una de ellas sea: "tejido adicto al hierro".
Las sospechas acerca del papel del hierro en la carcinogénesis y en la progresión del cáncer se acrecientan en los casos de ataxia de Friedrich, una afección en la cual se desequilibra la producción de una proteína mitocondrial llamada Frataxina y que conduce a una acumulación de hierro en la mitocondria y a la sobreproducción de ROS y estrés oxidativo (y ya hemos trazado una hipótesis que sigue el camino desde dicho estrés al inicio de la carcinogénesis y el de la acumulación del hierro con la progresión de un cáncer ya establecido). Pues bien: el riesgo de cáncer parece mayor en estos enfermos (estudio).
El hierro juega también un papel en la estabilización de los factores de crecimiento por hipoxia (HIF), que ya hemos estudiado y que tan importantes son para garantizar la progresión tumoral (estudio). A su vez, la HIF-1α conduce a la sobreexpresión de HO-1, que colabora en la degradación del hierro heme y la obtención de iones de hierro libre, y también se sobreexpresa ceruloplasmina, que oxida el hierro para facilitar su carga y transporte por la transferrina.
Ya hemos hablado de las CSC (células madre tumorales), que han iniciado una transición epitelio-mesenquimal para transformarse en células pluripotenciales, más capaces de desprenderse de la masa tumoral y de viajar a sitios distantes donde de nuevo harán la transición a una célula epitelial y consolidarán un nuevo foco tumoral distante. Son, por tanto, las células más peligrosas y agresivas, y las más resistentes a la terapia. Las células madre tumorales parecen acumular hierro de forma dramática (estudio).
Los niveles de la ferritina de cadena pesada (FTH-1, sububnidad H, que ya hemos mencionado), parecen regular los de TGF-β, que a su vez impacta considerablemente en la transición epitelio-mesenquimal (estudio). La ferritina intracelular se une al pool de hierro libre e impide que se desencadenen reacciones de oxidación-reducción que conducirían a la generación de ROS. Esos ROS desencadenan a su vez señales que facilitan la transición epitelio-mesenquimal. Además, el hierro unido a la ferritina no estaría disponible para otras reacciones metabólicas que la célula proliferativa necesitaría (estudio).
No es extraño, por tanto, que haya una correlación entre niveles aumentados de TGF-β y disminuidos de FTH-1, lo cual incrementa el pool de hierro libre disponible para generar ROS señalizadores de la transición epitelio-mesenquimal y permite la generación exagerada de enzimas dependientes del hierro, destinadas a que la célula prolifere.
Las células madre tumorales parecen presentar niveles aún menores de ferritina (y mayores de receptores de transferrina) que las adultas, y parece que extraen hierro del microambiente con aún mayor efectividad. La correlación es tan fuerte, que el hierro libre se presenta como uno de los objetivos clave en el crecimiento tumoral, lo que nos obliga a dedicarle un amplio espacio en el apartado dedicado a las acciones prácticas, sobre todo porque impacta de forma genérica en TODAS las células tumorales, y lo hace de forma directamente proporcional: es más vital cuanto más agresivas y peligrosas sean las células neoplásicas.
La acumulación de hierro libre conduce a un peligroso aumento de ROS, que sobrepasan la capacidad antioxidante de la célula, desequilibran el balance redox y pueden conducir a una muerte por ferroptosis. La célula tumoral contrarresta ese efecto potencialmente desastroso mediante dos posibles estrategias:
- Usando moléculas que anulan la precipitación de la cascada bioquímica que conduce a la muerte por ferroptosis. Por ejemplo, en este estudio se propuso la existencia de una pequeña molécula, que ellos denominan ferrostatina-1, que parece ser un inhibidor tanto de la ferroptosis como de la muerte inducida por glutamato, presente en altas cantidades en la célula tumoral, y que podría explicar su vigor a pesar de las altas cantidades de hierro y glutamato presentes en su citosol.
- Mediante una sobreproducción de antioxidantes, que hemos estudiado en profundidad en un apartado anterior de este mismo libro (cuyo principal representante es el glutatión peroxidasa, o GPX-4). Por lo tanto, el abordaje terapéutico que intente desequilibrar el balance redox tumoral hará potente sinergia con las acciones destinadas a aprovechar el efecto oxidante del exceso de hierro en el tumor.
- Las quelantes específicas del hierro tumoral, que impedirían el crecimiento y harían sinergia con las medidas estándar.
- Las que usan una estrategia opuesta: no inciden en el hierro intratumoral o incluso permiten que aumente su presencia dentro del tumor, para incrementar la cantidad de ROS generados con acciones oxidantes, mientras se dificulta a la vez la generación de antioxidantes endógenos tumorales. El objetivo será desequilibrar el balance redox y alcanzar una ferroptosis limitada al tumor.
Anemia inducida por el cáncer y su valor pronóstico de evolución
Es habitual que se produzca en enfermos de cáncer una aparente paradoja: la evolución de la enfermedad conduce a una anemia debida a deficiencias de hierro (a pesar de que la ferritina plasmática suele elevarse significativamente; ya hemos visto que no hay siempre una correlación entre niveles de ferritina y almacenaje de hierro, y que la ferritina extracelular tiene otras funciones diferentes a las que muestra intracelularmente). Aproximadamente 1 de cada 3 pacientes de cáncer muestran signos de anemia incluso antes de iniciar el tratamiento.
Esa deficiencia puede estar relacionada con la presencia en alta cantidad de citoquinas proinflamatorias (como la IL-6) segregadas tanto por el tumor como por las células del sistema inmune. Ese desequilibrio bioquímico conduce a una deficiencia en la eritropoiesis y una menor supervivencia de los eritrocitos circulantes. A la alteración en los eritrocitos se une el secuestro sistémico del hierro por parte del tumor, que impide su uso por la hemoglobina (estudio).
Esos hechos constituyen una nueva pista de que el tumor interacciona con el organismo y lo "convence" para ponerlo a su servicio, como haría con un embrión. De pronto el organismo supone que la supervivencia depende de que esa masa que crece sea convenientemente nutrida, aún a expensas del resto de tejidos, lo que puede conducir, paradójicamente, a la muerte. La caquexia y la anemia son dos de los principales problemas sistémicos asociados al cáncer y que, a su vez, exacerban la progresión de la enfermedad en dos delirantes círculos viciosos.
Esa es otra razón más para abordar siempre una estrategia terapéutica dual: resolver la comunicación tumor-organismo para que este último no malinteprete la verdadera naturaleza del tejido neoplásico y para proveerlo de las herramientas que permitan que optimice su salud; y, además, enviar ataques directos y frontales contra el tumor, entendiendo su especial realidad 'alternativa' y separada del organismo del que es huésped.
La anemia asociada al cáncer ha demostrado ser un factor pronóstico de gran importancia (estudio, estudio, estudio) y su abordaje tiene implicaciones antitumorales, algo que no siempre es tenido en cuenta al tratar a los enfermos (estudio). Puede que los elevados niveles de hepcidina de los pacientes de cáncer guarden una relación causal con la anemia. Lo que es seguro es la fuerte correlación inversa entre los niveles de hepcidina y los de hemoglobina, razón de más para considerar el abordaje de la hepcidina (hepática y propia del tejido neoplásico) como un importante objetivo terapéutico (estudio).
La deficiente oxigenación tisular que conlleva la anemia puede exacerbar la hipoxia (libro) que, como ya hemos estudiado, es un potente acelerador tumoral y un factor que contribuye a la resistencia a la quimio y la radioterapia (estudio).
A su vez (de nuevo causas y consecuencias entremezclándose en potentes círculos viciosos) otro de los efectos secundarios de la quimioterapìa y la radioterapia es que exacerban aún más la anemia, al impedir la correcta eritropoiesis, con lo que se suma un nuevo daño estructural al problema previo (estudio).
Resolver ese problema prescribiendo suplementación de hierro al paciente oncológico ferropénico puede ser un tremendo error, por cuanto dicho hierro será captado en su mayor parte por el tumor, que lo utilizará para crecer aún más y no se resolverá la anemia asociada a la patología. Es otro de esos círculos viciosos que la medicina se empecina en tratar sin matiz, de forma reduccionista e ingenua.
Además, hay una 'zona dulce' de valores de hemoglobina donde se produce la oxigenación máxima tumoral y los mejores resultados. Tanto la anemia como el exceso de hemoglobina son perjudiciales. En mujeres se ha estimado que está entre los 12-14 g/dL y en hombres entre los 13-15 g/dL (estudio).
En Oncología Metabólica, proyecto dedicado a proponer medidas totalmente prácticas, estudiaremos cómo impedir que el tumor use el hierro (o volver ese acaparamiento en su contra), mientras a la vez nos aseguramos que sí lo utiliza el cuerpo sano y tratamos o evitamos la anemia ferropénica.
----------------------------------------------
Libros imprescindibles para caminar hacia un paradigma realmente útil y eficaz
La «Enciclopedia del Cáncer» es una serie de 7 libros revolucionarios. El recurso definitivo para aquellos que buscan una comprensión profunda de esta enfermedad compleja. Te lleva a un viaje de conocimiento sin precedentes que cambiará la forma en que entiendes esta enfermedad.
Si buscas opciones de tratamiento más allá de los enfoques convencionales, la «Enciclopedia del Cáncer» te presenta una amplia gama de terapias innovadoras que mejoran el pronóstico y ofrecen esperanza real a los enfermos de cáncer. Estas páginas contienen valiosas herramientas y estrategias que pueden marcar la diferencia en la lucha contra esta enfermedad.
A partir de la hipótesis de que todos los cánceres son una única enfermedad metabólica, analiza los "puntos débiles" específicos que comparten y que los diferencia de los tejidos sanos y propone terapias prácticas combinadas que podrían mejorar considerablemente la cantidad y calidad de vida de los enfermos.
Explorando el cáncer desde múltiples puntos de vista, estos libros lo analizan con una perspectiva metabólica, desentrañando los misterios que rodean su origen y desarrollo. Descubre cómo el sistema inmunológico, la microbiota, el metabolismo, las emociones y la biofísica están interconectados en la batalla contra el cáncer.
La precompra incluye pertenencia a grupo privado que comparte experiencias y resultados. Y dará acceso durante un año al proyecto Oncología Metabólica, una revolución terapéutica colaborativa: una comunidad pionera en el diseño empírico colectivo de terapias combinadas con un enfoque metabólico, que mejorará radicalmente el tratamiento.
Al precomprar el pack de libros te ahorrarás casi un 70% respecto de la compra individual de cada libro (cada libro sale de esa forma a menos de 9 euros).




el oxigeno elimina celelas cancerosas y otros organismos anaerobios...