¿Cómo desarrollaron las células un proceso para poner fin a sus propias vidas? Investigaciones recientes sugieren que la apoptosis, una forma de muerte celular programada, surgió por primera vez hace miles de millones de años en bacterias con una socialidad primitiva.

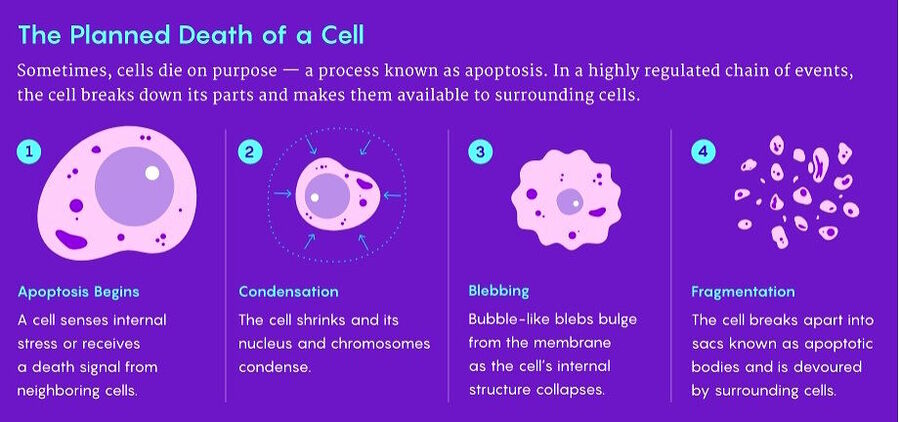
Parece que sigue con su actividad habitual, transcribiendo genes y fabricando proteínas. Los orgánulos de la central energética, las mitocondrias, están muy ocupados produciendo energía. Pero entonces una mitocondria recibe una señal y sus proteínas, típicamente plácidas, unen sus fuerzas para formar una máquina de la muerte.
Rebanan la célula con una minuciosidad pasmosa. En cuestión de horas, todo lo que la célula había construido yace en ruinas. Sólo quedan unas burbujas de membrana.
"Es realmente asombroso lo rápido y organizado que es", afirma Aurora Nedelcu, bióloga evolutiva de la Universidad de New Brunswick que ha estudiado el proceso en las algas.
La apoptosis, como se conoce a este proceso, parece tan improbable como violenta. Y, sin embargo, algunas células se someten a esta devastadora pero predecible serie de pasos para suicidarse a propósito. Cuando los biólogos la observaron por primera vez, se sorprendieron de encontrar la muerte autoinducida en organismos vivos y vigorosos. Y aunque resultó que la apoptosis es una fuerza creativa vital para muchas criaturas pluricelulares, para una célula determinada es totalmente ruinosa. ¿Cómo pudo evolucionar, por no hablar de persistir, un comportamiento que provoca la muerte súbita de una célula?
Los biólogos moleculares han descubierto que las herramientas de la apoptosis están, curiosamente, muy extendidas. Y a medida que han tratado de comprender su proceso molecular y sus orígenes, han encontrado algo aún más sorprendente: la apoptosis puede rastrearse hasta antiguas formas de muerte celular programada llevadas a cabo por organismos unicelulares -incluso bacterias- que parecen haberla desarrollado como un comportamiento social.
Cuando una célula de melanoma humano es desmantelada desde el interior por las enzimas, muestra los violentos signos de la apoptosis: encogimiento de la célula y el núcleo, condensación de la cromatina y "blebbing" (formación de burbujas a lo largo de la membrana celular a medida que se colapsan las estructuras internas). Vídeo de Nanolive
Las conclusiones de un estudio, publicado el pasado otoño, sugieren que el último ancestro común de la levadura y los humanos -el primer eucariota, o célula con núcleo y mitocondrias- ya disponía de las herramientas necesarias para acabar consigo mismo hace unos 2.000 millones de años. Y otras investigaciones, entre ellas un artículo clave publicado el pasado mes de mayo, indican que cuando ese organismo estaba vivo, algún tipo de muerte celular programada ya tenía millones de años.
Algunos investigadores creen que los orígenes de la apoptosis practicada en nuestras células podrían remontarse a la mitocondria, que curiosamente ocupa un lugar central en el proceso. Otros, sin embargo, sospechan que los orígenes de la muerte celular pueden estar en un antiguo acuerdo entre nuestros antepasados y las bacterias. Sea como fuere, las nuevas investigaciones aportan indicios prometedores de que la muerte celular programada puede ser más antigua y universal de lo que se pensaba. ¿Por qué la vida es tan acechada por la muerte?
Cuando la muerte es el plan
A finales de la década de 1950, el biólogo celular Richard Lockshin quedó fascinado por lo que ocurre con los tejidos que un organismo ya no necesita. Trabajaba en el laboratorio de la Universidad de Harvard del experto en insectos Carroll Williams, que había adquirido 20.000 capullos de gusanos de seda en Asia; cuando llegaron al laboratorio, su metamorfosis ya había comenzado. Dentro de cada capullo, las células de los gusanos estaban muriendo para permitir a la criatura convertirse en una polilla de seda. Lockshin llegó a documentar la muerte selectiva de tejidos en el interior de sus cuerpos, lo que denominó "muerte celular programada".
Más o menos al mismo tiempo, el patólogo australiano John Kerr observaba con un microscopio electrónico las células de embriones de rata y realizaba un descubrimiento similar. A medida que el embrión se desarrollaba, se iban añadiendo nuevas células al plan corporal. Sin embargo, también morían células. No era un accidente ni el resultado de una lesión. Esta muerte, a la que llamó "apoptosis", era "un fenómeno activo e inherentemente controlado", escribió Kerr. En los embriones de rata, la muerte era el plan.
Los investigadores que observaron este tipo de muerte acabaron por encontrar una explicación razonable. Durante el desarrollo, un globo de células que se dividen rápidamente se convierte en algo con alas y antenas, o dedos de manos y pies. Por el camino, algunas de esas células tienen que apartarse del camino del resto. Incluso en los adultos, la muerte celular programada tiene sentido desde el punto de vista científico. Las células enfermas -como las que acumulan daños en el ADN- deben ser capaces de eliminarse a sí mismas de un cuerpo pluricelular, no sea que causen una destrucción adicional a las células que las rodean. Los investigadores también descubrieron que fallos en la apoptosis podían dar lugar a enfermedades, lo que también resultaba coherente. En el cáncer, una célula que debería haber muerto -una célula cuyo ADN tiene tantos errores que debería haberse autoeliminado- no lo hace. En las enfermedades autoinmunes y de otro tipo, las células que no deberían morir lo hacen, y viceversa: las células que deberían morir no lo hacen.
Sin embargo, los expertos suponían que esta habilidad era exclusiva de los organismos pluricelulares, que tenían cuerpos formados por muchas células por las que otras podrían morir. ¿Qué beneficio podría sacar un organismo unicelular de su propia muerte? La evolución difícilmente podría favorecer un comportamiento que eliminara a su portador del acervo genético.
"No parecía tener sentido por qué un organismo se suicidaría activamente", señaló Pierre Durand, biólogo evolutivo de la Universidad de Witwatersrand (Sudáfrica).
Pero a medida que los científicos fueron perfilando estos protocolos de muerte con más detalle, algunos empezaron a darse cuenta de que los eucariotas unicelulares tenían herramientas y capacidades similares. En 1997, un equipo de investigadores dirigido por el bioquímico Kai-Uwe Fröhlich informó sobre células de levadura que se autodesmantelaban metódicamente: el primer caso conocido de un "eucariota inferior unicelular" que disponía de la maquinaria básica de la muerte celular programada. Pronto, algas unicelulares, protistas y otros hongos se unieron a las filas de las criaturas conocidas por su muerte autoinducida.
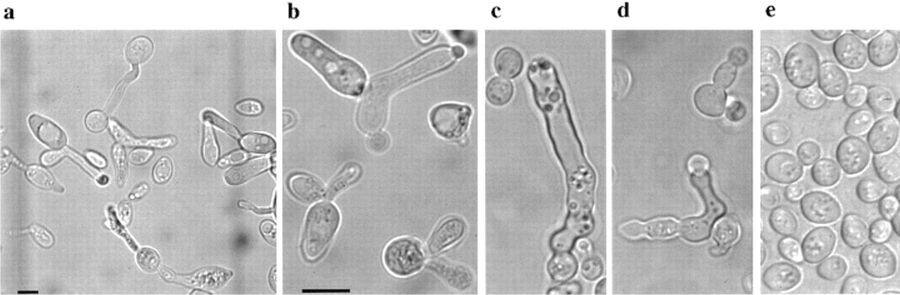
Las herramientas para el trabajo
Esto es lo que ocurre cuando una célula eucariota se condena a sí misma a morir.
En primer lugar, llega una señal que indica que ha llegado el final. Si procede del exterior de la célula -si las células circundantes han marcado a su vecina para la muerte-, la señal llega a la superficie de la célula y se une a un receptor de muerte, que pone en marcha la apoptosis. Si la señal procede del interior de la célula -por ejemplo, si el motivo de la muerte es un daño en el genoma-, el proceso comienza con las mitocondrias volviéndose contra su célula huésped.
En cualquiera de los dos casos, pronto entran en acción enzimas especializadas. Algunos factores apoptóticos, como las caspasas en los animales, pueden activarse entre sí en una cascada de sorprendente rapidez que se convierte en un enjambre y corta las estructuras de la célula en tiras. Después, el destino de la célula está sellado.
"Hay muchos caminos hacia la muerte celular", afirma L. Aravind, biólogo evolutivo del Centro Nacional de Información Biotecnológica. Todos terminan con enzimas apoptóticas y con fragmentos de proteína y ADN en el lugar donde solía estar la célula.
La apoptosis está tan estrechamente controlada y se practica tan ampliamente que es difícil no preguntarse dónde se originaron sus mecanismos: tanto las piezas que componen la máquina, que deben haber surgido primero, como la forma en que trabajan juntas. Esa curiosidad es la que llevó a Szymon Kaczanowski y Urszula Zielenkiewicz, de la Academia Polaca de Ciencias, a realizar una serie de experimentos recientemente. Querían saber si las proteínas apoptóticas de un eucariota funcionarían si se conectaban a la máquina apoptótica de un pariente lejano. Si el proceso seguía funcionando, pensaron, entonces las funciones de las enzimas -la forma en que cortan y trocean el ADN o activan otras partes de la maquinaria- debían de haberse conservado en gran medida durante largos periodos de tiempo.
También se preguntaron si las proteínas bacterianas podrían sustituir a las eucariotas. Cuando introdujeron genes de proteínas análogas procedentes de un puñado de bacterias, el equipo observó muerte programada en algunas quimeras, pero no en todas. Esto sugería que las herramientas para la muerte autoinducida eran anteriores incluso a los eucariotas, concluyeron los investigadores.
No todo el mundo está de acuerdo con su interpretación. Algunas de estas proteínas, especialmente las que cortan el ADN y las proteínas, son peligrosas para la célula, dijo Aravind; una célula podría morir simplemente a causa del daño, en lugar de a causa de un proceso apoptótico.
Aun así, Kaczanowski y Zielenkiewicz creen que lo que observan es una auténtica muerte celular programada. Y una de sus especulaciones sobre por qué los genes bacterianos podrían funcionar en eucariotas conecta con una idea que los biólogos llevan barajando durante décadas.
La teoría tiene que ver con la mitocondria, un organelo que en su día fue una bacteria de vida libre. Es la productora de energía de la célula. También aparece una y otra vez en las vías de la apoptosis. Guido Kroemer, que estudia el papel de las mitocondrias en la apoptosis, las apodó "los organelos suicidas".
"Muchos las llaman", dijo Nedelcu, "el verdugo central de la muerte celular".
¿Un trabajo desde dentro?
Bajo el microscopio, la mitocondria es una pequeña cosa muy bonita, un rombo ordenado que contiene un laberinto de membranas. Descompone los azúcares para generar ATP, una molécula cuya energía impulsa casi todos los procesos celulares. No sabemos exactamente cómo acabó en nuestro interior: La bacteria original pudo ser presa de nuestro antepasado unicelular y escapar a la digestión por medios aún misteriosos. Pudo ser una célula vecina que compartió recursos con nuestro antepasado hasta que sus destinos se entrelazaron tanto que sus cuerpos se unieron.
Sea cual sea su origen, la mitocondria tiene su propio pequeño genoma, remanente de sus días de independencia. Pero muchos de sus genes se han trasladado al genoma del huésped. En 2002, Aravind y Eugene Koonin escribieron un artículo histórico en el que consideraban la idea de que los eucariotas podrían haber obtenido algunos de sus genes de apoptosis de las mitocondrias. Este pequeño resto de bacteria podría ser la fuente de algunas herramientas que las células eucariotas utilizan para suicidarse.
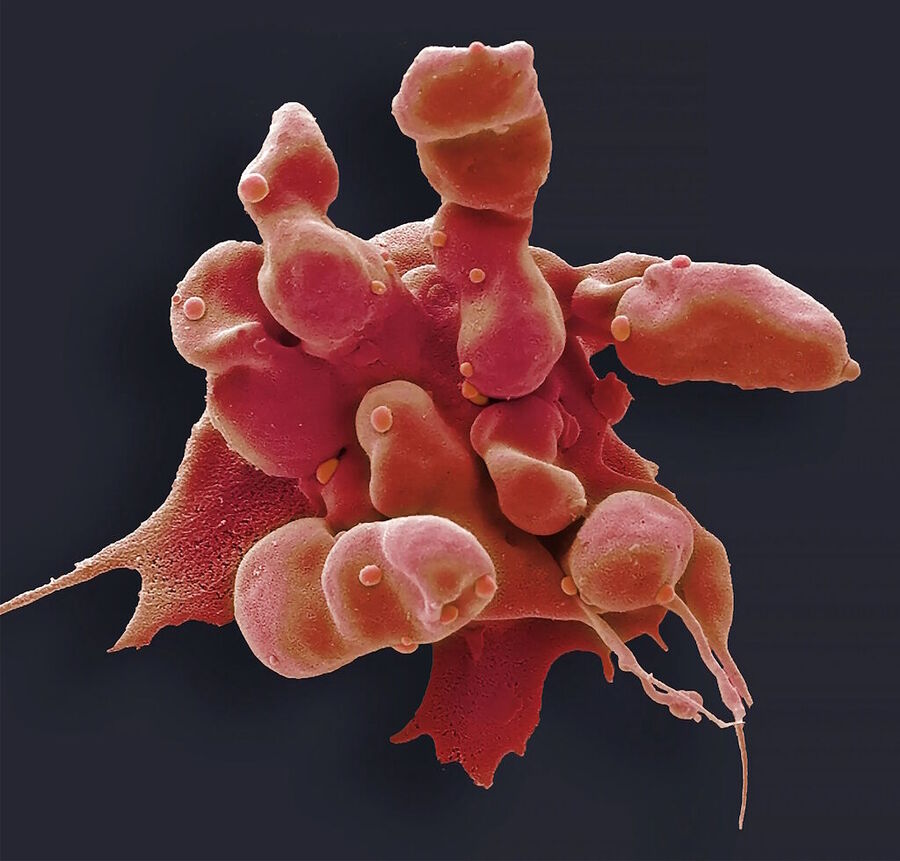
Quizá, una vez atrapadas en el interior de nuestro antiguo antepasado, las proteínas apoptóticas se convirtieron en una forma en que la mitocondria estresaba al huésped para que cambiara su comportamiento, reza una hipótesis recogida por Durand y Grant Ramsey, filósofo de la ciencia, en una revisión que publicaron el pasado mes de junio. O quizá sean los restos de una forma en que la mitocondria se aseguraba de que el huésped no pudiera deshacerse de ella: un veneno para el que sólo la mitocondria poseía el antídoto. En algún momento, el proceso fue capturado o transformado por el huésped, y una variante evolucionó hacia la apoptosis propiamente dicha.
La búsqueda de respuestas sobre el origen de la apoptosis eucariota parece estar llevando a los investigadores a adentrarse en el mundo bacteriano. De hecho, algunos se preguntan si las respuestas pueden estar en el porqué de que los organismos unicelulares se quiten la vida. Si alguna forma de muerte celular programada es más antigua que la vida pluricelular -más antigua incluso que los eucariotas-, tal vez entender por qué se produce en organismos sin cuerpos a los que beneficiar y sin mitocondrias que aceleren el proceso pueda explicar cómo empezó todo esto.
Por el bien de algún todo
He aquí una razón por la que un organismo unicelular podría optar por morir: para ayudar a sus vecinos.

La muerte celular programada parecía crear recursos aprovechables a partir de partes muertas. Sin embargo, descubrió que este proceso sólo beneficiaba a los parientes de las algas muertas. "En realidad era perjudicial para las de una especie diferente", dijo Durand. En 2022, otro grupo de investigación confirmó el hallazgo en otra alga.
Los resultados explican posiblemente cómo puede evolucionar la muerte celular en criaturas unicelulares. Si un organismo está rodeado de especies afines, su muerte puede proporcionar nutrición y, por tanto, favorecer la supervivencia de sus parientes. Esto permite que la selección natural escoja las herramientas para la muerte autoinducida.
Las bacterias también son unicelulares y pueden vivir entre sus congéneres. ¿Pueden morir también por un bien mayor? Hay indicios de que, en las condiciones adecuadas, las bacterias infectadas por un virus pueden suicidarse para detener la propagación de la enfermedad. Estas revelaciones han reconfigurado la forma de pensar de los investigadores sobre la muerte celular programada, y Aravind ha descubierto recientemente otra pieza del rompecabezas.
Ésta tiene que ver con unas regiones proteínicas denominadas dominios NACHT, que aparecen en algunas proteínas de apoptosis animal. Los dominios NACHT también existen en las bacterias. De hecho, en la naturaleza, los microbios que tienen más dominios NACHT a veces participan en lo que se parece mucho a la vida multicelular, dijo Aravind. Crecen en colonias, lo que los hace especialmente vulnerables al contagio y especialmente propensos a beneficiarse del autosacrificio de los demás.
Aaron Whiteley, colega de Aravind, y su laboratorio de la Universidad de Colorado equiparon E. coli con dominios NACHT y las cultivaron en tubos de ensayo. A continuación, infectaron las células con virus. Sorprendentemente, descubrieron que las proteínas portadoras de NACHT eran necesarias para desencadenar una forma de muerte celular programada, en la que las células infectadas se suicidaban tan rápidamente que los virus eran incapaces de replicarse. Según Aravind, su sacrificio podría proteger de la infección a otros en su entorno.

Ya no cree que las pruebas apunten a la mitocondria como única fuente bacteriana de proteínas de la apoptosis. La mitocondria es el principal resto bacteriano que aún vive dentro de la mayoría de las células eucariotas, y hace 25 años era el candidato lógico para estos misteriosos genes, dijo. Sin embargo, en los años transcurridos desde entonces, algo más ha quedado claro: la mitocondria probablemente no estaba sola.
Las bacterias en nosotros
Los investigadores se han ido dando cuenta de que los genomas eucariotas contienen muchos rastros de genes bacterianos, restos de un desfile silencioso de otras criaturas que dejaron sus huellas en nosotros. Pueden haber sido simbiontes, como la mitocondria, que entraron y salieron de varios linajes eucariotas, dejando genes tras de sí. "Ahora debemos darnos cuenta de que esta situación probablemente continuó a lo largo de toda la evolución eucariota", afirma Aravind.
Los genes implicados en la apoptosis pueden proceder de antiguos socios simbióticos que se han ido. O pueden ser el resultado de la transferencia horizontal de genes -un proceso que antes se creía raro y ahora se considera relativamente extendido-, en el que los genes pueden saltar de un organismo a otro a través de procesos que aún se están estudiando. Paquetes de genes útiles pueden saltar entre reinos de la vida y persistir en nuevos organismos si los beneficios son lo suficientemente grandes.
Uno de esos beneficios, curiosamente, parece ser la autodestrucción programada.
Todo esto es importante porque pone de relieve la enmarañada realidad que subyace a la simplista frase "la supervivencia del más fuerte". La evolución funciona de forma sorprendente, y los genes tienen muchas finalidades. Sin embargo, lo que cada vez está más claro es que algún tipo de colectividad primitiva -y, con ella, el autosacrificio organizado de los seres vivos- existió posiblemente durante miles de millones de años antes de que surgiera la vida multicelular. Tal vez, a medida que los científicos sigan desentrañando los orígenes de la muerte celular, descubramos una noción más amplia de para qué sirven la muerte y la vida.
Veronique Greenwood es escritora y ensayista científica. Sus trabajos han aparecido en The New York Times Magazine, Smithsonian, Discover, Aeon y otras publicaciones.




Comentario: (enlaces en inglés)