El siguiente artículo de LiveScience proporciona algunas pistas sobre cómo el corazón y los pulmones pueden verse seriamente afectados durante una infección por COVID-19:
La misteriosa conexión entre el coronavirus y el corazónUn informe preliminar sobre el tabaquismo y la hospitalización por COVID-19 plantea la misma cuestión de si este portal de las moléculas de ACE2 es dañino o beneficioso. Todos sabemos que fumar es terrible para la gente y está relacionado con muchas enfermedades, ¿verdad? Bueno, lo desconcertante es que a los fumadores y exfumadores parece que les va mejor que a los no fumadores en lo que se refiere a las complicaciones del COVID-19. El siguiente artículo "plantea la hipótesis de que la nicotina puede tener efectos beneficiosos en relación al COVID-19":
"Estamos viendo casos de personas que no tienen una enfermedad cardíaca subyacente, que están sufriendo daños cardíacos", dijo la Dra. Erin Michos, directora adjunta de cardiología preventiva de la Facultad de Medicina de la Johns Hopkins. El daño cardíaco no es típico en los casos leves de COVID-19, y tiende a ocurrir más a menudo en pacientes que tienen síntomas severos y son hospitalizados, dijo. [...]
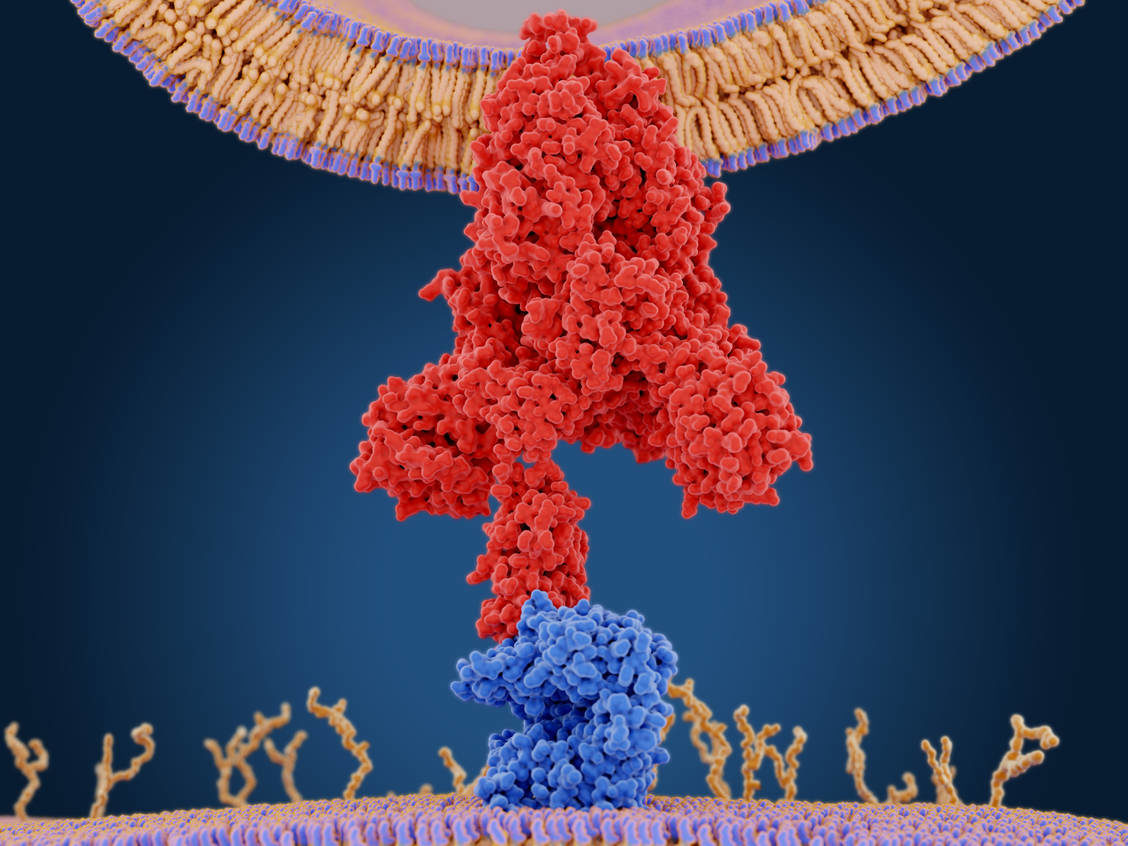
Tanto las células del corazón como las del pulmón están cubiertas de proteínas de superficie conocidas como enzimas convertidoras de angiotensina 2 (ACE2); estas moléculas sirven como "puertas" para que el virus entre en las células. Pero esta enzima es un "arma de doble filo", dijo. Por un lado, la molécula ACE2 actúa como una puerta de entrada para que el virus entre en la célula y se replique, pero por otro lado, normalmente cumple una función "protectora", dijo Michos.
Cuando los tejidos del cuerpo se dañan, ya sea por un virus invasor como el SARS-CoV-2 o por otros medios, la respuesta natural de curación del cuerpo implica la liberación de moléculas inflamatorias, como pequeñas proteínas llamadas citoquinas, en el torrente sanguíneo. Pero paradójicamente, un exceso de inflamación puede en realidad empeorar las cosas. La enzima ACE2 actúa como antiinflamatoria, evitando que las células inmunes causen más daño a las propias células del cuerpo.
Pero cuando el virus se engancha a las proteínas ACE2, estas proteínas quedan fuera de servicio, reduciendo posiblemente la protección antiinflamatoria que dan. Por lo tanto, el virus puede estar actuando de manera doblemente perjudicial, dañando directamente las células y evitando que el cuerpo proteja los tejidos del daño inflamatorio.
"Si el músculo cardíaco se inflama y se daña por el virus, el corazón no puede funcionar", dijo.
El nuevo coronavirus también podría dañar indirectamente el corazón. En este escenario, el sistema inmunológico del paciente termina "enloqueciendo", dijo Michos. Este escenario se ha presentado en algunos pacientes realmente enfermos que tienen marcadores inflamatorios muy elevados, es decir, proteínas que señalan altos niveles de inflamación en el cuerpo.
Esto se llama "tormenta de citoquinas", dijo Michos. Las tormentas de citoquinas dañan los órganos de todo el cuerpo, incluyendo el corazón y el hígado, añadió. No está claro por qué algunas personas tienen una respuesta tan elevada en comparación con otras, pero algunas personas podrían ser genéticamente propensas a ello, añadió. [...]
Es muy difícil determinar si tener más ACE2 es útil o perjudicial, ya que estas proteínas son la forma en que el virus entra en las células, pero también se sabe que protegen a las células contra las lesiones, dijo Michos.
Fumar, vapear y hospitalización por COVID-19Para explicar por qué a los fumadores parecía irles mejor, los autores especulan que la nicotina podría tener efectos inmunomoduladores beneficiosos. Sin embargo, afirman además que las interacciones entre la nicotina y el eje renina-angiotensina-aldosterona siguen sin estar claras.
Konstantinos Farsalinos1, Anastasia Barbouni1, Raymond Niaura2Resumen
- Universidad de Ática Occidental, Atenas, Grecia
- Universidad de Nueva York, Estados Unidos
El propósito del estudio era examinar la prevalencia del consumo actual de cigarrillos electrónicos y del hábito de fumar entre los pacientes hospitalizados con COVID-19 en China, teniendo en cuenta la elevada prevalencia del hábito de fumar en la población del país (26,6%, 50,5% en los hombres y 2,1% en las mujeres). El 1º de abril se realizó una investigación sistemática de la literatura (PubMed). De 432 estudios, identificamos 13 estudios que examinaban las características clínicas de un total de 5960 pacientes hospitalizados por COVID-19 que presentaban datos sobre el hábito de fumar. Ningún estudio informó sobre el uso de cigarrillos electrónicos entre los pacientes de COVID-19. La prevalencia del tabaquismo corriente osciló entre el 1,4% y el 12,6%. La prevalencia combinada de efecto aleatorio del tabaquismo corriente fue del 6,5% (IC del 95%: 4,9-8,2%). Este análisis preliminar no apoya el argumento de que el tabaquismo corriente sea un factor de riesgo de hospitalización para el COVID-19. En cambio, estas observaciones coherentes, que se ven reforzadas por la baja prevalencia de los fumadores corrientes entre los pacientes de COVID-19 en los Estados Unidos (1,3%), plantean la hipótesis de que la nicotina puede tener efectos beneficiosos con respecto al COVID-19. Esto podría atribuirse a sus efectos inmunomoduladores y a su interacción con el sistema renina-angiotensina. Sin embargo, es necesario tener en cuenta otros factores de confusión y determinar la exactitud del registro de la situación de fumadores. No obstante, los resultados fueron notablemente coherentes en todos los estudios y se verificaron recientemente en la primera serie de casos de COVID-19 en los Estados Unidos. En conclusión, el consejo generalizado de dejar de fumar como medida para mejorar el riesgo para la salud sigue siendo válido, pero actualmente no se puede hacer ninguna recomendación sobre los efectos del tabaquismo en el riesgo de hospitalización por COVID-19. No se han identificado estudios que registren el estado de uso del cigarrillo electrónico entre los pacientes hospitalizados de COVID-19. Por consiguiente, no se puede hacer ninguna recomendación para los usuarios de cigarrillos electrónicos. Las observaciones mencionadas, junto con los posibles mecanismos por los que la nicotina interactúa con el proceso inflamatorio y el eje renina-angiotensina-aldosterona que interviene en el desarrollo del COVID-19, justifican una investigación urgente de los efectos clínicos de la nicotina farmacéutica en la susceptibilidad, la progresión y la gravedad del COVID-19.
En el otro extremo de este debate, el siguiente artículo publicado en The American Journal of Physiology considera que la nicotina tiene un efecto perjudicial en el cuerpo a través del mismo sistema:
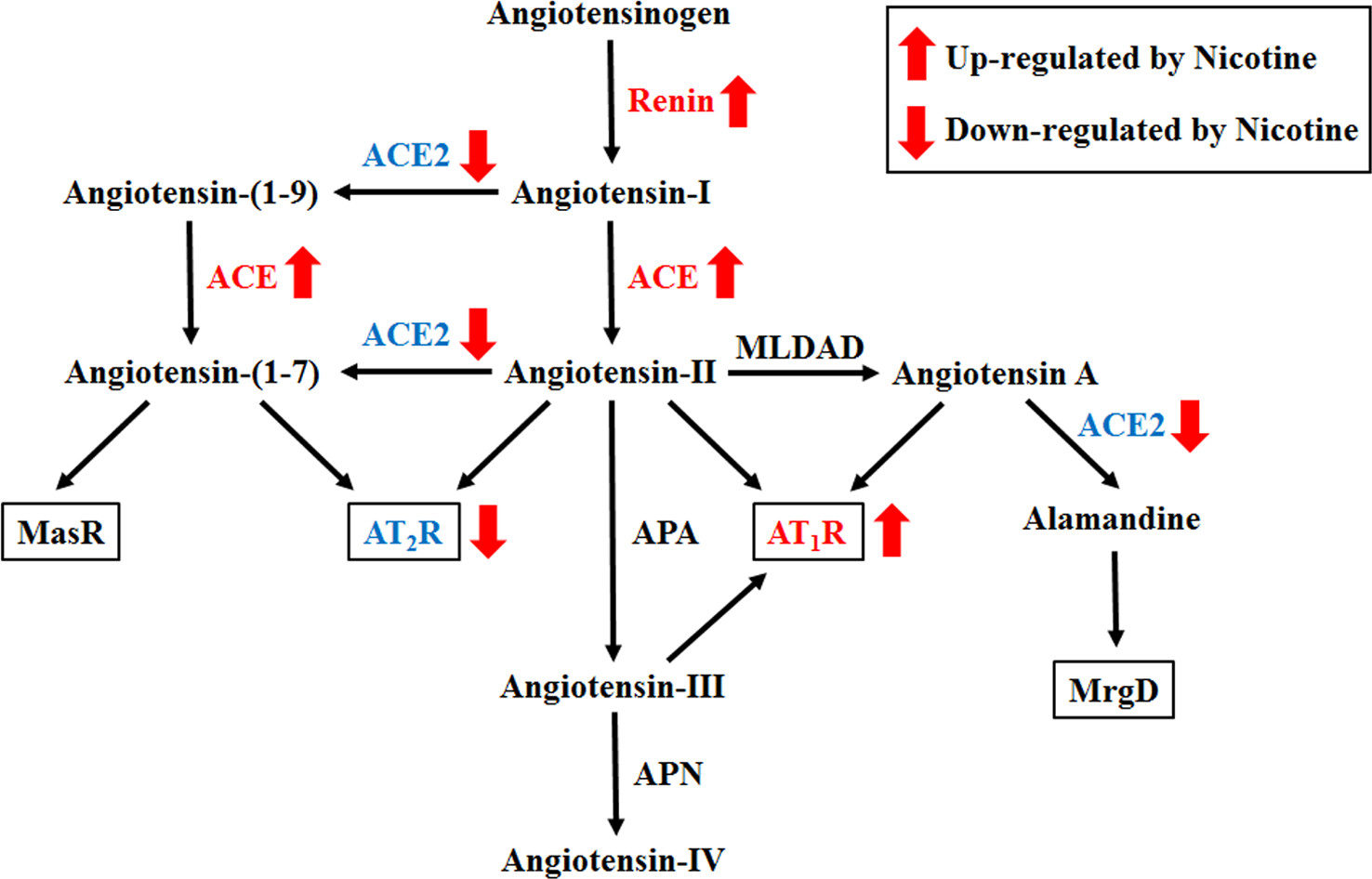
La nicotina y el sistema renina-angiotensinaEste artículo incluye un gráfico para ilustrar lo que se conoce sobre la nicotina y la vía de la angiotensina:
doi.org/10.1152/ajpregu.00099.2018
Esta revisión se centra en la interacción entre la nicotina y el sistema renina-angiotensina (SRA), uno de los sistemas reguladores más importantes de las funciones autonómicas, cardiovasculares y pulmonares tanto en la salud como en la enfermedad. La bibliografía presentada en esta revisión sugiere firmemente que la nicotina altera la homeostasis del SRA al regular de forma ascendente el eje de los receptores de la enzima convertidora de angiotensina (ECA)/angiotensina (ANG)-II/ANG II tipo 1 y de forma descendente el eje de los receptores compensatorios ACE2/ANG-(1-7)/Mas, contribuyendo al desarrollo de la enfermedad pulmonar obstructiva crónica (EPOC).
El nervio vago es el corazón del sistema nervioso parasimpático. Es el propio "sistema antiestrés" del cuerpo. El nervio vago es su nervio calmante y relajante, que se extiende desde el cerebro hasta el abdomen, dividiéndose en múltiples ramas que llegan a la garganta, el corazón, los pulmones y todas las vísceras. También se le llama "el vagabundo", ya que vaga por todo tu cuerpo. Cuando respiras profundamente, este nervio errante se activa y libera acetilcolina, que reduce la producción de moléculas inflamatorias como las citoquinas. Recordemos la "tormenta de citoquinas" que ocurre en los casos graves de COVID-19.
Los receptores de acetilcolina, también conocidos como receptores colinérgicos, se dividen en dos categorías basadas en sustancias químicas que imitan o antagonizan la acción de la acetilcolina sobre sus células diana. En estudios clásicos, la nicotina, aislada del tabaco, era una de las sustancias químicas utilizadas para distinguir los receptores de acetilcolina. Esto se debe a que nuestros cuerpos contienen receptores nicotínicos para la acetilcolina. Las personas que fuman suelen sufrir un ligero deterioro temporal de sus capacidades cognitivas cuando dejan de fumar, hasta que sus cuerpos se reajustan al cese del influjo de nicotina. Este empeoramiento se debe a que la nicotina actúa como agonista para imitar los receptores de acetilcolina, lo cual es importante para el aprendizaje, la memoria y las funciones cognitivas.
La producción de citoquinas, así como el factor de necrosis tumoral (TNF) y la interleucina-6 (IL-6), nos protegen contra los patógenos y promueven la reparación de los tejidos, pero la liberación excesiva de citoquinas puede dar lugar a una inflamación sistémica, fallo de los órganos y, en última instancia, la muerte, como está sucediendo en algunos pacientes con COVID-19.
La regulación autónoma de la inflamación local y sistémica, es decir, el enlace molecular entre el cerebro y el sistema inmunológico, se realiza a través de la vía colinérgica antiinflamatoria. Este es el mecanismo que comprende el nervio vago y su neurotransmisor, la acetilcolina; un proceso que depende de la subunidad alfa-7 del receptor nicotínico de la acetilcolina (α7 nAChR).
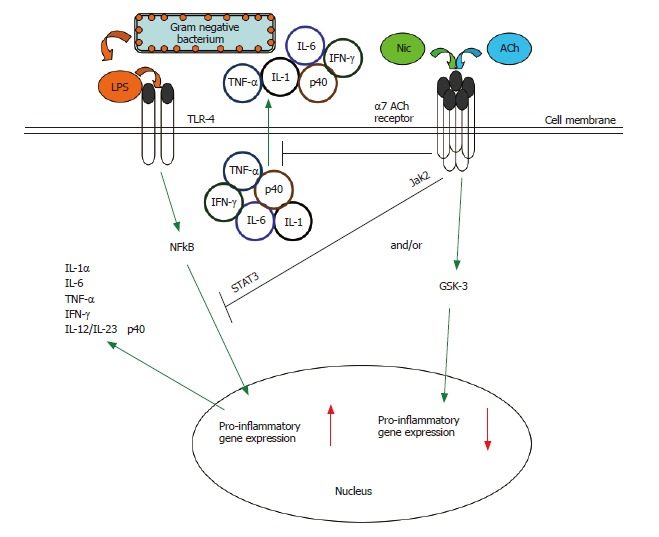
En el siguiente gráfico, en el que una infección bacteriana promueve la producción excesiva de citoquinas, se ofrece un resumen de la vía colinérgica antiinflamatoria, que se activa endógenamente (internamente) por la acetilcolina (Ach) o exógenamente (externamente) por la nicotina (Nic):
¿Cómo es posible entonces que la vía antiinflamatoria colinérgica dependiente del nAChR α7 sea tan fácilmente pasada por alto o ignorada?
Como terapeuta de la terapia neural, es imposible que me pase por alto esta conexión. De hecho, todos los terapeutas neurales saben que el sistema nervioso autónomo (o sistema nervioso vegetativo) es el sistema más subestimado de la medicina convencional, pero es fundamental para todo lo que nos rodea: la rapidez con que nos curamos de las lesiones, la percepción del dolor, el funcionamiento del sistema digestivo, la rapidez de los latidos del corazón, la capacidad de regular el estrés y la inflamación, etc. Conecta todos los sistemas del cuerpo, y los datos muestran que puede hacerlo de forma no lineal.
Su sistema nervioso autónomo tiene una función clave para regular muchos, si no la mayoría de los sistemas de su cuerpo, y funciona de manera eficaz para hacerlo hasta el momento en que cualquier aflicción se convierte en la "gota que colma el vaso". Por muy banal que parezca una nueva enfermedad o queja al principio, si aparece después de una serie de ataques previos a su sistema, lo más probable es que el sistema nervioso autónomo haya "colapsado" y ya no regule el caos en su cuerpo.
Su nueva enfermedad, que de otra manera sería trivial, podría (para un médico alopático incapaz de identificarla a través de pruebas estándar como la endoscopia, el ultrasonido, las exploraciones, etc.) parecer no estar relacionada con problemas sistémicos o crónicos. Pero esto se debe probablemente a que él o ella se está perdiendo el "panorama general". La terapia neural, también conocida como Medicina Reguladora, se basa en la activación del sistema parasimpático "antiestrés" y su vía colinérgica antiinflamatoria para que una persona pueda regular mejor el estrés y la enfermedad.
El sistema nervioso autónomo es una gran red de fibras nerviosas que va desde el cerebro a todo el cuerpo y viceversa, con neuronas que llegan a la mayoría de los órganos de nuestro cuerpo. Estas neuronas liberan sustancias químicas que afectan a las células de destino en nuestros órganos. Lo que esto significa es que, independientemente de los productos químicos que afectan a las células de destino, como el sistema renina-angiotensina, que es un tema candente en las últimas publicaciones de varias revistas revisadas por expertos, el sistema nervioso autónomo sigue siendo la "mente maestra" que regula procesos como la vasoconstricción o la vasodilatación (constricción o dilatación de los vasos sanguíneos).
El sistema nervioso autónomo regula todas las funciones involuntarias de nuestro cuerpo; por ejemplo, los ojos, las glándulas (salivales, lagrimales, sudor), los vasos sanguíneos, el corazón, la laringe, la tráquea, los bronquios, los pulmones, el estómago, las glándulas suprarrenales, los riñones, el páncreas, el intestino, la vejiga y los genitales externos. Se divide en dos subsistemas aparentemente opuestos: el simpático y el parasimpático. El sistema simpático se asocia con una respuesta de lucha o huida ante un peligro como una infección. Por el contrario, el sistema parasimpático, como hemos examinado anteriormente, se asocia con el crecimiento, la restauración y la regeneración.
Es por eso que la activación de la rama parasimpática del sistema nervioso autónomo nos ayuda a reducir la inflamación. Frena la hiperactividad de la rama simpática en respuesta a un exceso de estrés por una infección viral.
Volvamos al principal punto de entrada a las células para el COVID-19, la enzima convertidora de angiotensina 2 (ACE2):
Se sabe que la enzima convertidora de angiotensina 2 (ACE2) está presente en la mayoría de los órganos. La ACE2 está adherida a la membrana celular de las células epiteliales alveolares que se encuentran principalmente en los pulmones, los enterocitos del intestino delgado, las células endoteliales arteriales y venosas y las células del músculo liso arterial en la mayoría de los órganos. La expresión del ARNm de la ACE2 también se encuentra en la corteza cerebral, el cuerpo estriado, el hipotálamo y el tronco encefálico.La corteza cerebral, el cuerpo estriado, el hipotálamo y el tronco cerebral están repletos de neuronas colinérgicas, y todas ellas forman parte de nuestro sistema nervioso. También se relacionan con nuestro yo consciente, el aprendizaje y la memoria.
Como dije al principio, un miembro de mi círculo cercano sobrevivió a una miocarditis fulminante inducida por un virus y a una extraña patología pulmonar. Salió de la UCI y regresó a casa antes de que su fiebre reapareciera un par de semanas después y fue tratado con éxito con piperacilina-tazobactam. Él no fuma y estuvo a punto de morir. También recibió varias sesiones de terapia neural (entre muchas otras intervenciones terapéuticas) para ayudarle a combatir su tormenta de citoquinas. La buena noticia es que, desde entonces, ha tenido una excelente recuperación y está muy satisfecho con la forma en que su cerebro está trabajando. Sus habilidades cognitivas están mejor que nunca. ¡No está mal para alguien que tiene más de 75 años y se gana la vida haciendo matemáticas y física!
Referencias adicionales
- Pavlov, Valentin A. The cholinergic anti-inflammatory pathway. Brain, Behavior, and Immunity 19 (2005) 493 - 499.
- Rosas-Ballina, M. et al. Cholinergic control of inflammation. Journal of Internal Medicine, 2009: 265; 663-679.
- Van Westerloo, David J., The vagal immune reflex: a blessing from above. Wiener Medizinische Wochenschrift (2010) 160/5 - 6:112 - 117.




¿Quién está realizando experimentos con humanos y por qué?
Traducido por el equipo de SOTT.net en español Países de todo el mundo han estado luchando contra la pandemia de coronavirus desde hace meses, lo que está exponiendo un número creciente de...porque casa con mi experiencia y lo que supe de tanta gente infectada por "gripes atípicas".