Fatiga, insomnio, depresión, ansiedad, baja libido, poca tolerancia al estrés, piel seca, poca calidad de sueño, apatía, antojo por lo dulce o salado, infecciones frecuentes, dolores de cabeza, cicatrización lenta de heridas, irregularidades menstruales, diarrea, estreñimiento, pérdida de cabello, palpitaciones, manos y pies fríos, mala regulación de la temperatura corporal, baja azúcar en la sangre, aumento del esfuerzo requerido para realizar las tareas diarias, falta de energía, intolerancias alimentarias, alergias, etc...El doctor quiropráctico y naturópata James Wilson, basado en el trabajo previo de pioneros en el campo de la fisiología del estrés, incluyendo a Hans Selye, afirma haber acuñado el término "fatiga suprarrenal" en 1998. Desde entonces, se han publicado toda una serie de libros sobre el tema, y una simple búsqueda en Google muestra más de 403.000 resultados.
Una breve introducción a la "Fatiga Suprarrenal"
De acuerdo a Wilson, el padecimiento se describe como algo así:
La fatiga suprarrenal es un grupo de signos y síntomas relacionados (un síndrome) que resulta cuando las glándulas suprarrenales funcionan por debajo del nivel necesario. Más comúnmente asociado con el estrés intenso o prolongado, también puede surgir durante o después de infecciones agudas o crónicas, especialmente infecciones respiratorias como la influenza, la bronquitis o la neumonía.Las glándulas suprarrenales son pequeñas glándulas situadas en la parte superior de los riñones y son responsables de la producción y la liberación de una variedad de hormonas esteroides, incluyendo cortisol, adrenalina (epinefrina) y, en cierta medida, noradrenalina (norefinefrina). Estas hormonas están implicadas en una amplia variedad de procesos regulatorios como el control glucémico, la regulación de la inflamación, la movilización de energía y el metabolismo, y la respuesta al estrés/lucha o huída (entre otras cosas - demasiadas para enumerarlas aquí), y sin ellas estaríamos muertos.
La fatiga suprarrenal se produce cuando las glándulas suprarrenales no pueden satisfacer adecuadamente las demandas del estrés.*
Durante la fatiga suprarrenal, las glándulas suprarrenales funcionan, pero no lo suficientemente bien para mantener una homeostasis óptima porque su producción de hormonas reguladoras ha disminuido, generalmente por sobreestimulación. La sobreestimulación de las suprarrenales puede ser causada por un único evento estresante muy intenso, o por el estrés crónico o repetido que tiene un efecto acumulativo.*
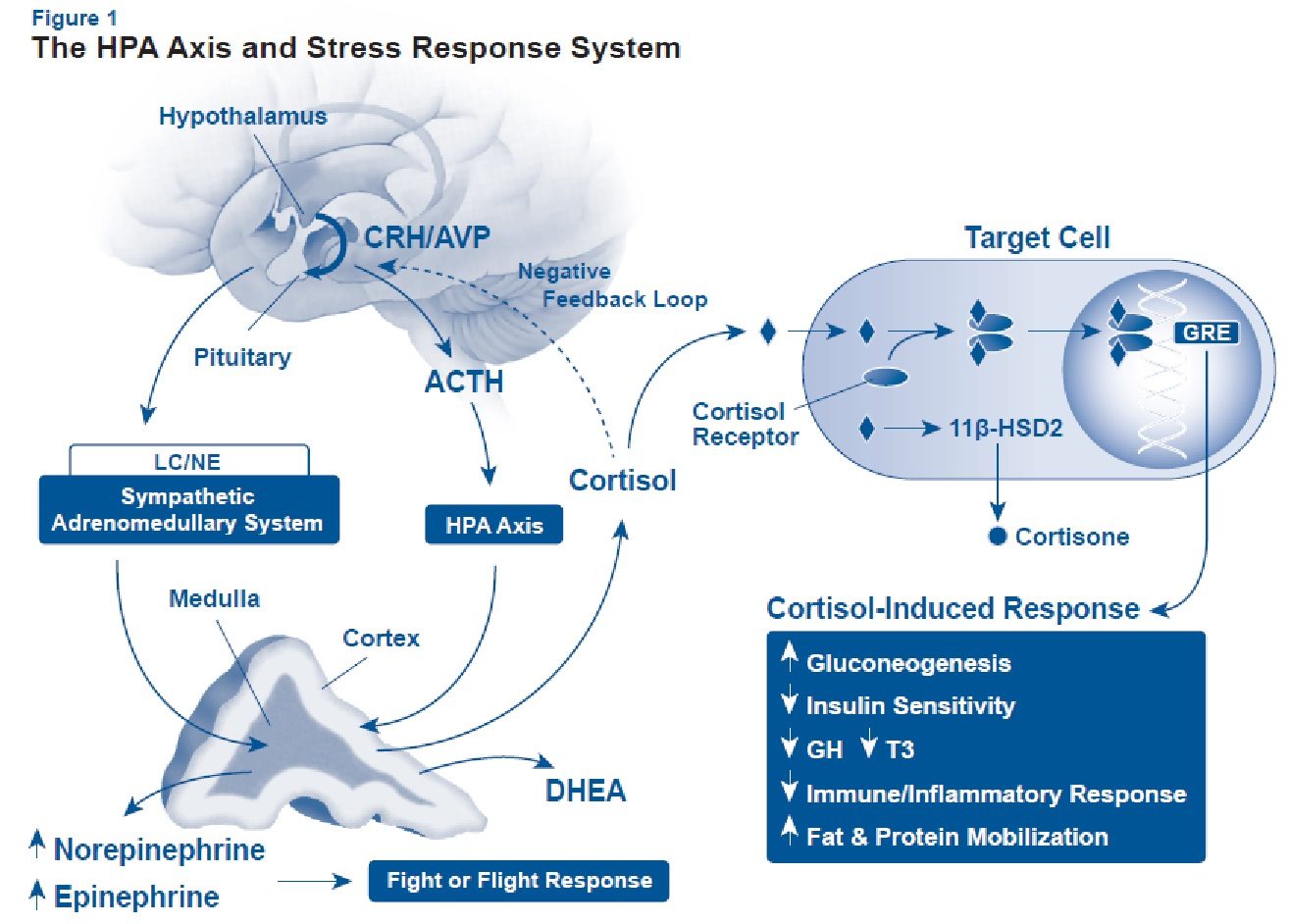
La gente a menudo equipara el estrés con eventos psicológica o emocionalmente desafiantes, como la pérdida de un ser querido, o la presión experimentada en casa o en el lugar de trabajo. Sin embargo, el estrés también tiene lugar a nivel fisiológico y puede ser lo suficientemente sutil como para eludir la atención consciente. Un factor estresante es cualquier evento o influencia que interrumpa el equilibrio o la homeostasis. Cuando el cuerpo se encuentra con un factor estresante, inicia una cascada de eventos denominada "respuesta al estrés". La respuesta al estrés implica una variedad de cambios fisiológicos coordinados por el eje hipotalámico-pituitario-adrenal (HPA) y mediados principalmente por las hormonas del estrés, incluyendo el cortisol y la adrenalina, y está diseñada para facilitar la adaptación a las condiciones adversas restaurando el equilibrio dentro del sistema.
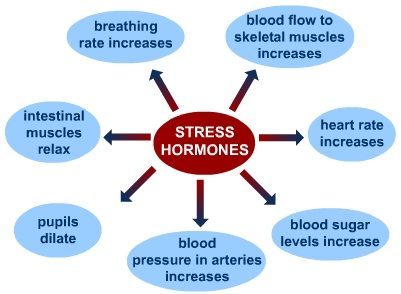
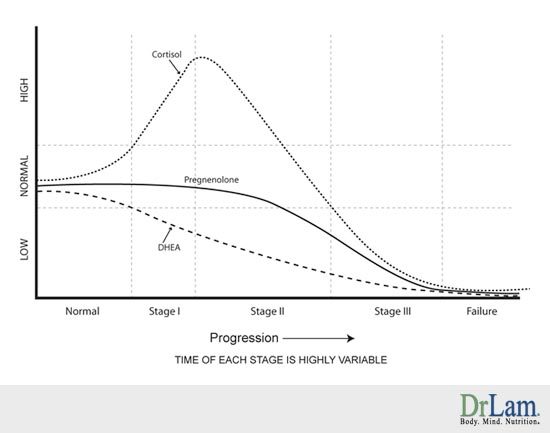
Los modelos populares de fatiga suprarrenal indican que su progresión ocurre en varias etapas. Inicialmente, la exposición a periodos de estrés crónicos o intensos puede inducir un estado de "hiperactividad", caracterizado por niveles constantemente altos de cortisol para satisfacer las demandas del entorno. Esto parece inclinar el equilibrio de estas hormonas hacia una mayor secreción de cortisol en relación a la DHEA.
El robo de pregnenolona: una teoría (ya caduca)
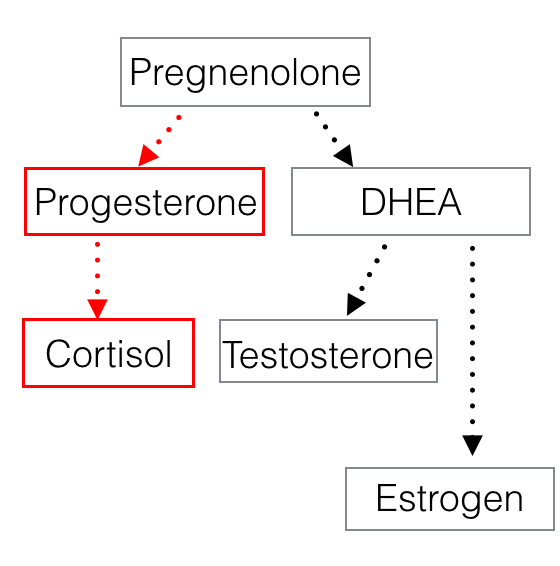
Dado que tanto el cortisol como la DHEA se derivan del mismo precursor constructor de hormonas llamado pregnenolona, se cree que (a través de un proceso llamado "el robo de pregnenolona") la reserva finita de la pregnenolona se utiliza para producir cortisol a expensas de la DHEA y otras hormonas sexuales que le siguen en la vía de conversión hormonal (estrógeno y testosterona). En otras palabras, la pregnenolona es la materia prima necesaria para producir todas las hormonas, por lo que una necesidad excesiva de cortisol agota la materia prima, y por lo tanto hay menos cantidad de la misma disponible para producir otras hormonas. El resultado = menor producción de hormonas sexuales, cortisol alto y DHEA bajo según se muestra en una prueba de hormona salival.
Este estado de cortisol alto puede durar mucho tiempo y se dice que efectivamente "agota las glándulas suprarrenales" de modo que las mismas no pueden continuar produciendo suficientes hormonas. Eventualmente, este estado "hiperactivo" se transforma en un estado "hipoactivo" en el que se producen niveles muy bajos de cortisol y DHEA. Esto se conoce como la fase final de "agotamiento" o "falla" en el diagrama de abajo. Para una visión general extensa de esto, usted puede ver este artículo.
Negación por parte de la medicina convencional: descartando lo bueno junto con lo malo
A pesar de la abundancia de evidencia anecdótica y experiencia clínica en el campo de la atención a la salud alternativa, la teoría de la "fatiga suprarrenal" ha sido cuestionada y criticada por muchos expertos en el campo de la endocrinología y la medicina convencional. Una revisión sistemática bastante reciente publicada en BMC Endocrine Disorders concluyó:
Esta revisión sistemática demuestra que no hay pruebas de que la "fatiga suprarrenal" sea una afección médica real. Por lo tanto, la fatiga suprarrenal sigue siendo un mito.Aunque hay un grupo de afecciones médicas establecidas en las que el rendimiento suprarrenal está gravemente comprometido, como la enfermedad de Addisons, la atrofia suprarrenal o la insuficiencia suprarrenal secundaria, no hay pruebas de que las glándulas suprarrenales no funcionen en alguien que no tenga una de las afecciones mencionadas anteriormente. De hecho, las glándulas suprarrenales en realidad parecen adaptarse muy bien a las afecciones estresantes persistentes, como se puede evidenciar por el hecho de que aumentan significativamente en tamaño en respuesta a los factores de estrés crónicos. Así que desde la perspectiva de la endocrinología convencional, la fatiga suprarrenal simplemente no existe. Y, en este caso, la medicina convencional está parcialmente en lo cierto.
Pero, ¿cómo podemos conciliar este hecho con la amplia gama de síntomas que experimentan miles de personas que no cumplen los criterios diagnósticos de la enfermedad de Addison o cualquier otra afección médica relacionada con las suprarrenales?
Bueno, existe una afección conocida actualmente como fatiga suprarrenal, pero la biología que la sustenta simplemente fue malentendida. Aunque la premisa de que las "glándulas suprarrenales no funcionan" puede ser fisiológicamente incorrecta, las experiencias de las personas que sufren de estos síntomas no deben ser ignoradas y rechazadas por los médicos convencionales. Es importante entender que términos como "fatiga suprarrenal", "cansancio suprarrenal" y "agotamiento suprarrenal" se han utilizado en el pasado para definir y explicar patrones complejos de mal funcionamiento relacionados con la respuesta al estrés. Ahora se entiende que este mal funcionamiento se origina principalmente en el cerebro.
Un trastorno cerebral por mala regulación del eje HPA: ¡La fatiga suprarrenal literalmente está en su cabeza!
El cerebro es el sistema de control central y las glándulas suprarrenales simplemente siguen órdenes. El autor de un artículo titulado "Physiology and neurobiology of stress and adaptation: central role of the brain" ("Fisiología y neurobiología del estrés y la adaptación: papel central del cerebro") afirma:
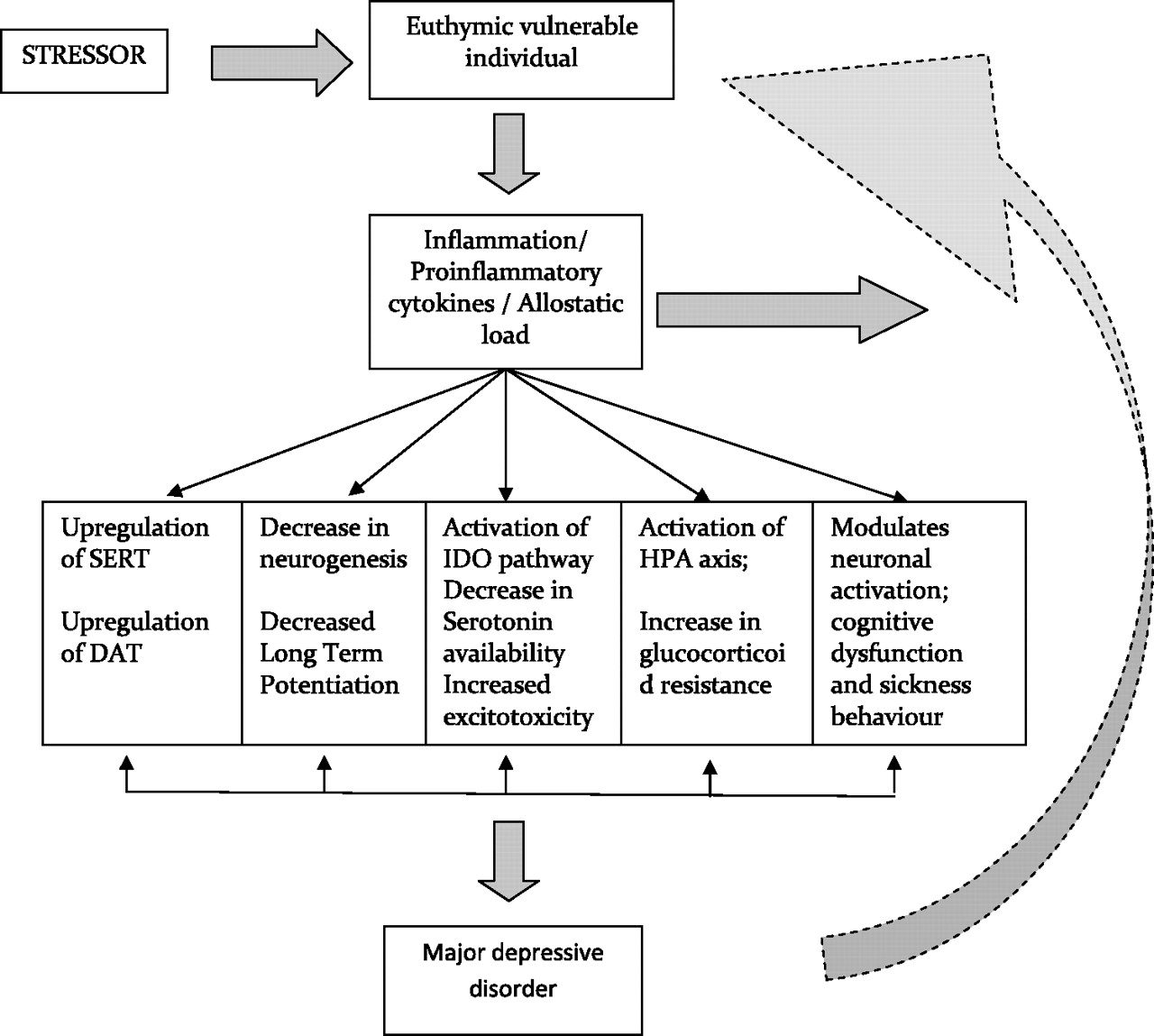
El cerebro es el órgano clave en la respuesta al estrés porque determina lo que es amenazador y, por tanto, potencialmente estresante, así como las respuestas fisiológicas y conductuales que pueden ser adaptativas o perjudiciales.En lugar de una falla de las glándulas suprarrenales para mantenerse a la altura de la demanda, los cambios adaptativos en la alteración hormonal inducida por el estrés se inician con mayor frecuencia dentro del hipotálamo y las glándulas pituitarias. El sistema regulador que gobierna la producción de la hormona suprarrenal del estrés (el cerebro) coordina los cambios en respuesta a la información interna y/o externa recibida, como una adaptación en condiciones adversas. La respuesta al estrés asigna recursos metabólicos y altera la fisiología para promover la supervivencia a corto plazo del organismo, a menudo a expensas de la salud a largo plazo.
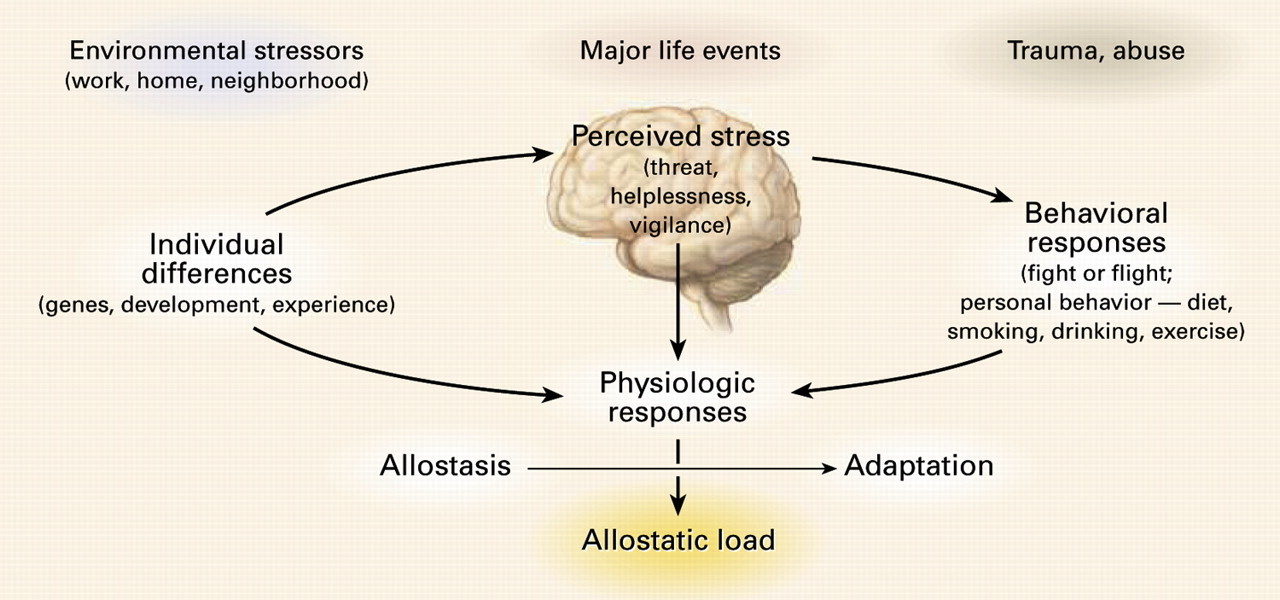
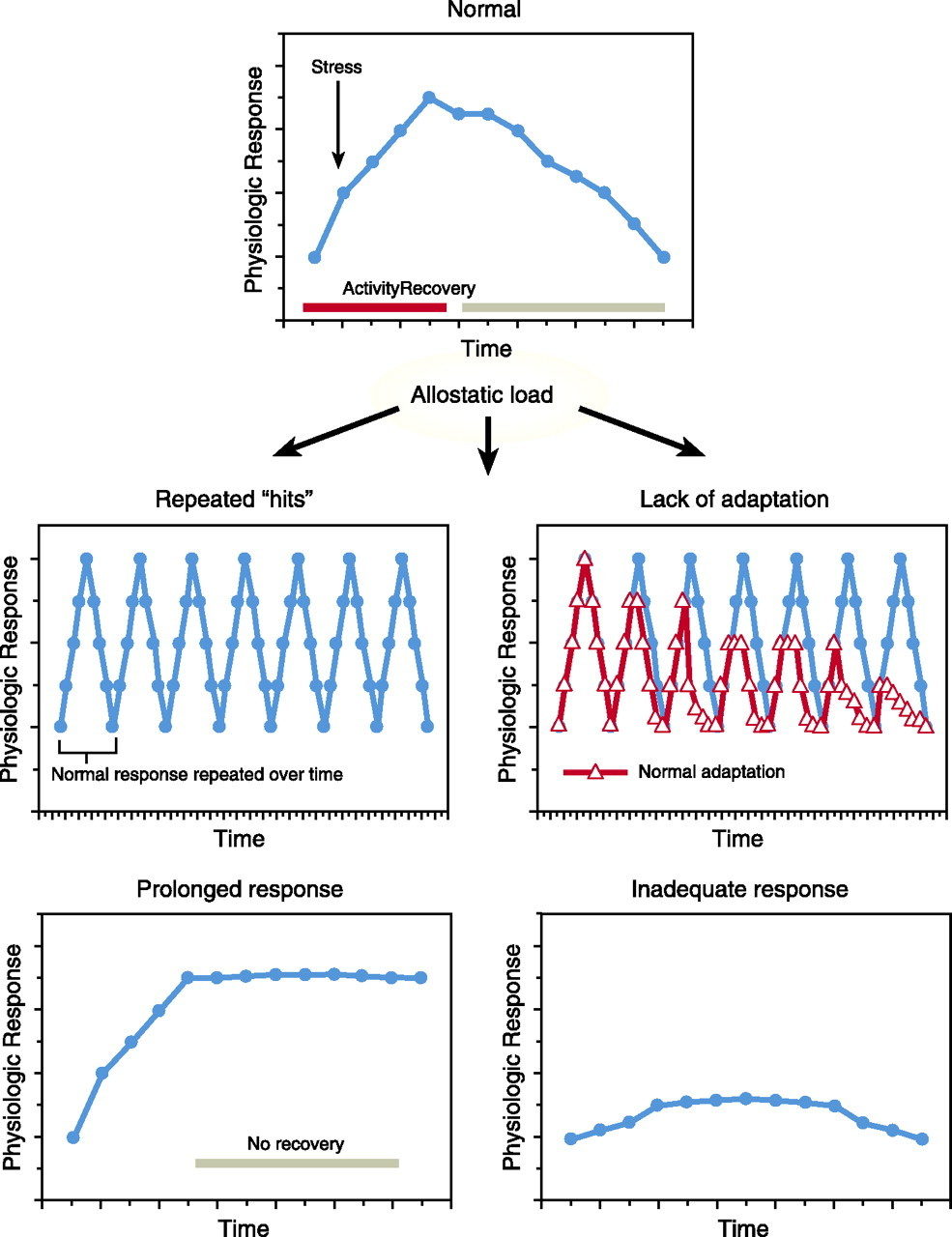
¿Por qué podría ser esto? En primer lugar, el cortisol descompone los tejidos incluyendo la masa muscular magra, los diversos órganos y las estructuras cerebrales, particularmente el hipocampo. En segundo lugar, el cortisol es un potente inmunosupresor, capaz de suprimir la función de las células inmunitarias y, en última instancia, reducir la inmunidad del huésped. La exposición a largo plazo al cortisol alto es suficiente para quebrar completamente las defensas del sistema y destruir órganos enteros. Por lo tanto, para proteger al cuerpo de la infección y la descomposición excesiva del tejido, es posible que el cerebro decida reducir la producción total de hormonas y efectivamente "cegarse" hasta que las condiciones mejoren. Desafortunadamente, para muchas personas las condiciones no mejoran, lo que resulta en la aparición de efectos peligrosos del cortisol bajo a largo plazo.
Desmintiendo el mito del "robo de la pregnenolona"
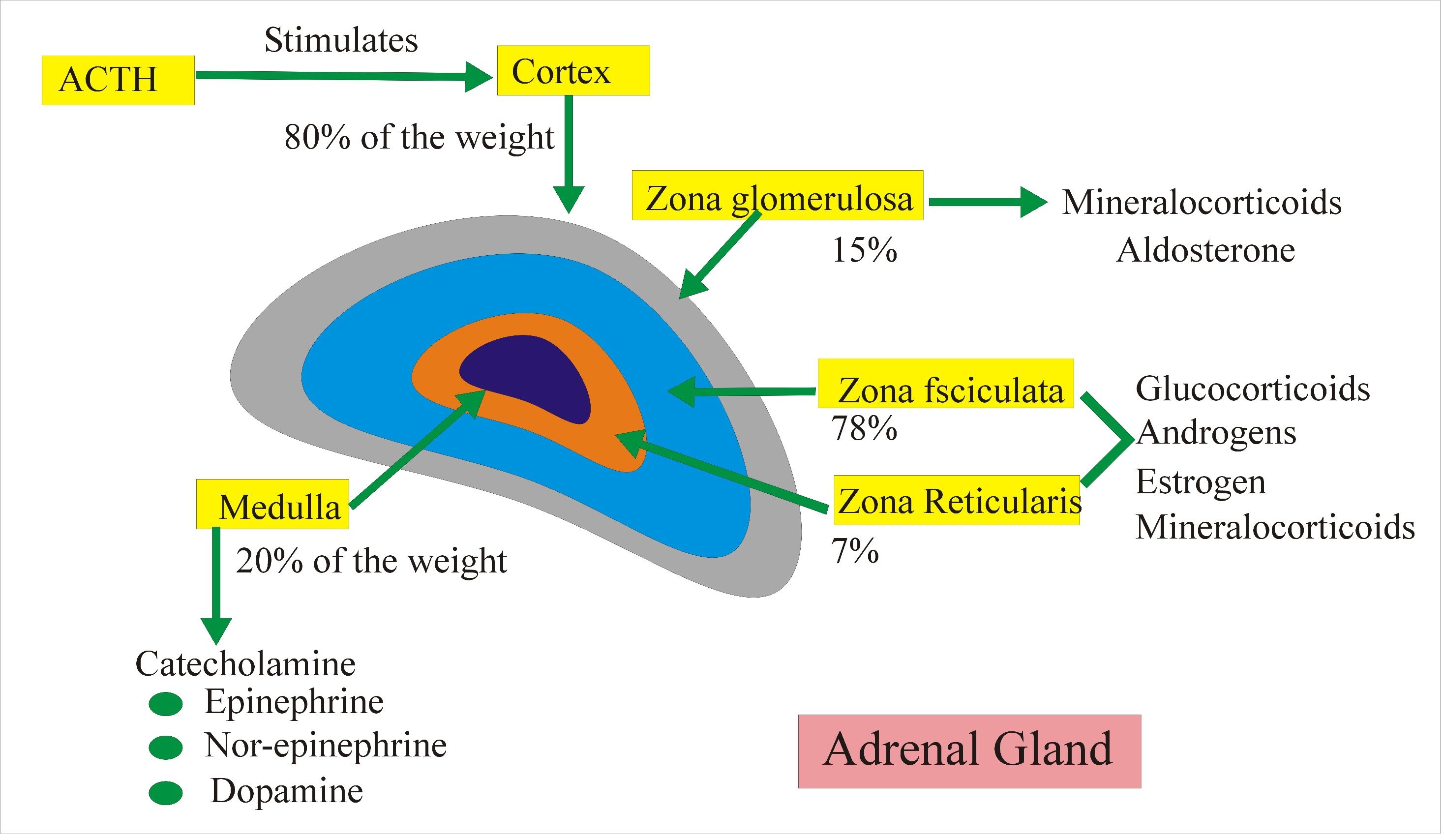
Como se muestra en el siguiente diagrama, la producción de hormonas ocurre en diferentes tejidos de las glándulas suprarrenales, y cada tejido tiene sus propios tipos únicos de células. Recuerden lo que escribí acerca de que la pregnenolona es el componente básico de todas las hormonas esteroides. Bueno, eso no es técnicamente cierto. El colesterol es en realidad la materia prima más básica, que se convierte en pregnenolona en las mitocondrias de cada célula respectiva, y luego PERMANECE en esa célula.
Por lo tanto, la noción de que la producción de hormonas esteroideas utiliza la pregnenolona de una sola "reserva" suprarrenal es fundamentalmente incorrecta. No se conoce ninguna reserva de pregnenolona que pueda transferirse entre las mitocondrias de diferentes tipos celulares. El robo de pregnenolona no existe.
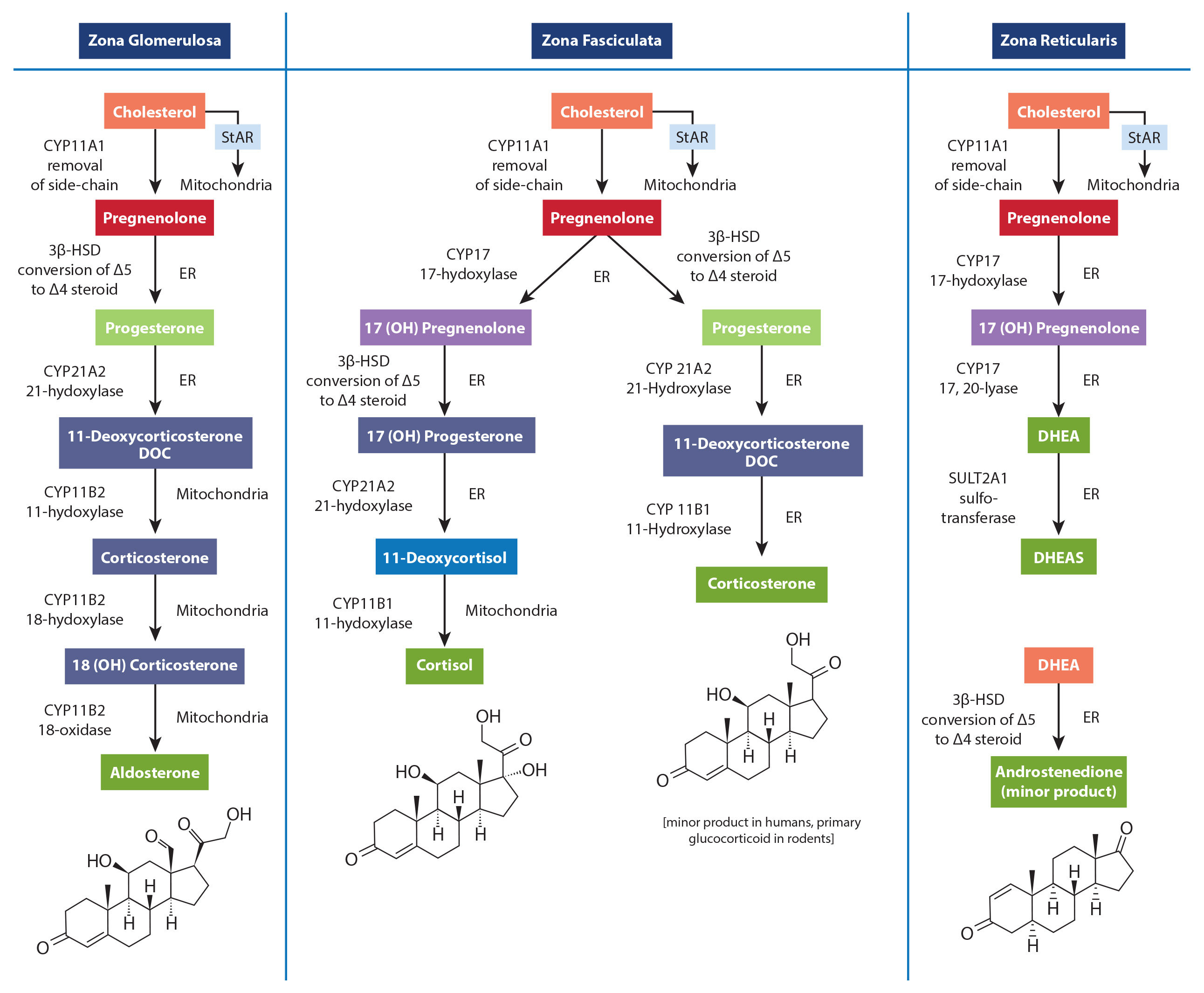
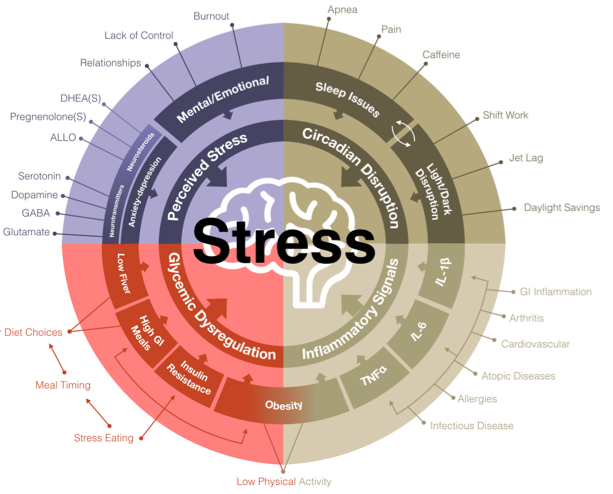
"... Además, la síntesis suprarrenal de cortisol impulsada por la ACTH es superior a la de la DHEA(S) y fluctúa radicalmente en un período de 24 horas. Si hubiera una "reserva de pregnenolona" suprarrenal que contuviera suficientes precursores de pregnenolona para una elevada producción de cortisol por la mañana (o durante el estrés), esta "reserva" también estaría disponible para la cantidad mucho más pequeña de DHEA(S) necesaria cuando la síntesis de cortisol cayera incluso un poco. Finalmente, como han demostrado décadas de investigación sobre la esteroidogénesis, el control de la producción de las hormonas suprarrenales está regulada principalmente por las concentraciones de enzimas específicas de la célula y las señales externas provenientes de fuera de las glándulas suprarrenales.Los cuatro factores principales que influyen en la disfunción del eje HPA
[...]
Si bien el estrés del eje HPA y la subsiguiente síntesis y secreción de cortisol pueden coincidir con la aceleración de la producción reducida de DHEA(S) (es decir, una regulación decreciente de la DHEA(S) inducida por el estrés), esta relación se ve facilitada por procesos reguladores (por ejemplo, inhibiciones de la retroalimentación, señalización de receptores, regulación genómica de enzimas, etc.), no un agotamiento intrasuprarrenal de la pregnenolona como precursor de las hormonas subsiguientes.
En un estudio realizado en sujetos con diabetes tipo 2 mal controlada con niveles elevados de cortisol y DHEA, se demostró que la enzima necesaria para la formación de DHEA en la zona reticularis (17,20 litasa) limitaba la producción de DHEA. La actividad enzimática se corrigió (así como la normalización casi completa de los niveles de cortisol, DHEA y DHEA-S) después de seis meses de dieta o farmacoterapia para mejorar el control glucémico.26
Además, los estudios de cultivo celular sugieren que bajo estrés inflamatorio (IL-4 y otras citocinas), la zona reticularis regulará la producción de DHEA cuando la ACTH esté presente. 27,28 Estos y muchos otros factores (por ejemplo, el envejecimiento) son probablemente la principal influencia en la relación dinámica entre el cortisol (activado por el eje HPA) y los niveles medidos de DHEA y/o DHEA-S."
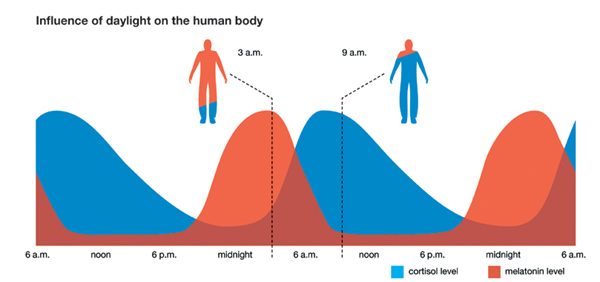
Los trastornos del sueño y un mal ritmo circadiano actúan como un potente estresante y son capaces de perturbar el eje HPA por sí mismos. El eje HPA está directamente ligado al ritmo circadiano y el cortisol normalmente sigue un ciclo de 24 horas que puede verse en la gráfica siguiente.
He aquí un extracto de un artículo sobre el tema:
La evidencia sugiere que varias hormonas y procesos metabólicos se ven afectados por la calidad del sueño y los ritmos circadianos; tales interacciones están mediadas por numerosos "genes reloj". Las hormonas como la hormona del crecimiento, la melatonina, el cortisol, la leptina y la grelina están estrechamente asociadas con el sueño y el ritmo circadiano, y los mecanismos endógenos de regulación circadiana tienen un papel importante en la homeostasis de la glucosa y los lípidos. Los trastornos y, especialmente, la privación del sueño se asocian con un mayor riesgo de obesidad, diabetes e insensibilidad a la insulina, así como con la mala regulación de la leptina y la grelina, que afectan negativamente a la salud humana. La alteración circadiana, que típicamente es inducida por el trabajo por turnos, puede afectar negativamente la salud debido a la alteración en la homeostasis de la glucosa y los lípidos, los ritmos invertidos de melatonina y cortisol, la mala regulación de la leptina y la grelina, el síndrome metabólico más severo y la pérdida del ritmo del gen reloj.Para más información, he escrito sobre los efectos de la luz artificial en la noche y la importancia de mantener un ritmo circadiano en este artículo
Mala regulación glucémica
La clasificación técnica del cortisol corresponde a un "glucocorticoide", lo que refleja el papel del cortisol en el mantenimiento de las concentraciones de glucosa en sangre. Cuando el nivel de azúcar en la sangre oscila a un nivel bajo (como en un estado de estrés), el cuerpo depende del cortisol para destruir el tejido muscular y activar la producción de glucosa en el hígado. Esto proporciona energía para el uso a corto plazo, pero puede ser gravemente perjudicial cuando ocurre a largo plazo.
Las personas con un control deficiente de la glucosa en la sangre (resistencia a la insulina, consumo de alimentos que aumentan excesivamente el nivel de azúcar en la sangre) pueden experimentar una "crisis" (caída de azúcar en la sangre) poco después de comer e inducir una respuesta al cortisol. El momento de la comida también es importante, ya que se ha demostrado que las comidas por la noche evocan un aumento mayor en el nivel de azúcar en la sangre que las comidas más tempranas del día y, posteriormente, aumentan la probabilidad de secreción de cortisol. Por lo tanto, el control eficaz de la glucosa en sangre con intervenciones dietéticas y cambios en el estilo de vida deberían ayudar en teoría en este aspecto.
Inflamación
Las citocinas pro-inflamatorias como las interleuquinas 1,6 y TNF-alfa actúan directamente sobre el hipotálamo para aumentar la producción de cortisol. El cortisol es un potente agente antiinflamatorio y se manifiesta cuando hay inflamación aguda o crónica en algún lugar del cuerpo. La inflamación crónica de bajo grado puede pasar desapercibida y, sin embargo, aumentar significativamente la carga alostática general. La inflamación de bajo grado puede provenir de intolerancias alimenticias ocultas, alergias no diagnosticadas, permeabilidad intestinal, afecciones inflamatorias y procesos autoinmunes crónicos, adiposidad/obesidad central, exposición al moho, toxicidad química, exposición a metales pesados o cualquier otra cosa que el cuerpo considere una amenaza.
Se ha propuesto que la exposición prolongada a las citocinas proinflamatorias puede inducir un estado de "resistencia al cortisol", en el que los receptores glucocorticoides se vuelven menos sensibles y, por lo tanto, el cortisol no puede ejercer su acción antiinflamatoria de las células. La interacción dinámica entre las células inmunitarias y el eje HPA es bidireccional, lo que significa que hay una vía de comunicación bidireccional. La inflamación crónica puede causar la mala regulación del eje HPA y el exceso de hormonas del estrés, mientras que la exposición prolongada a las hormonas del estrés también puede llevar a la inflamación crónica.
Las emociones asociadas con el estrés como el dolor, el miedo, la culpa, la ansiedad, la excitación y la vergüenza desencadenan una respuesta del eje HPA y aumentan el cortisol. Eventos tales como hablar en público o un viaje al consultorio del dentista también provocan respuestas fisiológicas similares. Sin embargo, la severidad de la respuesta y la capacidad de recuperación son muy individuales y tienen más que ver con la percepción que una persona tiene del evento, que con el evento en sí mismo.
Según el Dr. Thomas Guilliams:
Los cuatro factores clave que determinan la magnitud de la respuesta del eje HPA a un estresante mental/emocional son: 1) la novedad para la persona; 2) la naturaleza impredecible; 3) la amenaza para la persona o el ego; 4) la sensación de pérdida de control. Las características individuales del paciente son también profundamente influyentes. Las cualidades innatas como la edad, el sexo (preponderancia femenina) y la predisposición hereditaria, junto con las características de la personalidad (es decir, introversión y baja autoestima) y las experiencias prenatales y de la infancia temprana, sirven para individualizar y amplificar aún más la respuesta única de cada paciente al estrés.He aquí por qué es importante identificar aquellos aspectos de su vida que usted siente que le provocan más estrés, y luego encontrar maneras de tomar las precauciones apropiadas y, con suerte, eludir lo que es innecesario. Por supuesto, es imposible predecir cuándo ocurrirán los eventos estresantes de la vida, y un tanto de tensión es simplemente inevitable. Sin embargo, si nos tomamos el tiempo para observar y ser honestos con nosotros mismos, podemos muy rápidamente recopilar datos y obtener una cierta comprensión de los diversos patrones de comportamiento que rodean los sentimientos subjetivos de estrés.
Por ejemplo, usted puede notar que se estresa en la mañana porque se está apresurando para llegar al trabajo a tiempo. En este caso, podría hacer algunos cambios sencillos como despertarse media hora antes o empacar su almuerzo la noche anterior. Son esos cambios básicos los que realmente pueden marcar la diferencia cuando se trata de mejorar la salud.
Conclusión
La fisiopatología de la "fatiga suprarrenal" se caracteriza por patrones disfuncionales relacionados con el eje HPA. Debido a que no hay investigaciones para corroborar la idea de que las glándulas suprarrenales se fatiguen o no funcionen de alguna manera, es más apropiado referirse a la afección como la disfunción o desregulación del eje HPA.
Las causas exactas de la desregulación del eje HPA parecen ser complejas y multifacéticas. La investigación ha proporcionado evidencia de que hay cuatro áreas clave involucradas: 1) el estrés percibido; 2) el control del azúcar en la sangre; 3) los ritmos circadianos y 4) los procesos inflamatorios.
Teniendo esto en cuenta, el uso de suplementos diseñados para "apoyar a las suprarrenales" puede no ser suficiente para ayudar en la recuperación a menos que se hayan identificado y tratado las causas subyacentes de la disfunción del eje HPA.




Comentarios del Lector
a nuestro Boletín