La autofagia es un proceso metabólico de gran importancia en el cáncer, que cumple un papel contradictorio y a veces paradójico. Su abordaje es además diferente cuando hablamos de prevención que cuando hablamos de tratamiento.
En este artículo intento responder a todas las dudas que asaltan frecuentemente a los lectores en este tema, revisando la evidencia disponible.
He tratado de ser exhaustivo, y eso conlleva escribir un artículo (ya estarás acostumbrado) muy largo. Espero que lo comprendas, porque quienes abordamos el tema del cáncer no podemos permitirnos el lujo de ser superficiales.
No sólo trato cuestiones teóricas sino que incluyo un apartado para diseñar una estrategia terapéutica que aborde la autofagia y mejore (puede que mucho) la eficacia terapéutica de la quimioterapia.
Introducción
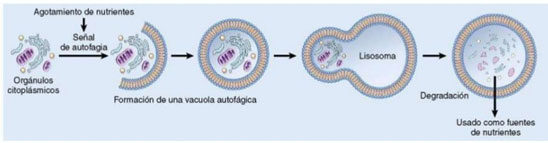
La autofagia, cuyos mecanismos fueron descubiertos por el premio nobel japonés Yoshinori Oshumi, es un antiguo proceso metabólico conservado en todas las células eucariotas: en momentos de escasez de combustibles metabólicos, dichas células reciclan algunos de sus componentes, proteínas y organelas "defectuosas", degradándolas mediante lisosomas, que extraen de ellos nutrientes que alimentarán a la célula.
Es un proceso que permite obtener energía cuando son escasos otros combustibles metabólicos y a la vez mantiene la homeostasis y la "limpieza" celular, renovando algunas organelas como las mitocondrias, pero también metabolizando agregados de proteínas vinculados a enfermedades neurodegenerativas. Y, muy importante, también puede desencadenarse cuando patógenos como bacterias o virus invaden el citoplasma. No es sólo un mecanismo metabólico, por tanto, sino también inmunitario (estudio).
Recientemente se ha reconocido su capacidad inmunoreguladora: no sólo sirve para mantener la homeostasis en diversas células del Sistema inmune, sino que éstas utilizan la autofagia de diversas formas para atacar a los invasores externos (estudio).
No es por ello sorprendente que su inadecuado funcionamiento se haya vinculado con numerosas enfermedades y su correcta manipulación pueda tener gran importancia terapéutica.
Tipos de autofagia
Se han clasificado 3 tipos de autofagia (estudio):
- Macroautofagia: es la que define lo que entendemos por autofagia. Se forman en la célula vesículas de doble membrana, llamadas autofagosomas, alrededor de una porción de citoplasma, que engolfan las organelas que se van a metabolizar. Esas vesículas se fusionan con lisosomas, cuyas enzimas hidrolíticas y proteolíticas degradan y metabolizan el contenido del autofagosoma.Recordemos que el interior de los lisosomas debe permanecer a un ph bastante ácido para que sus enzimas funcionen correctamente. Ese hecho tendrá importantes implicaciones que explicaremos más adelante (estudio)
- Microautofagia: en este caso las proteínas u organelas son atrapadas directamente por los lisosomas mediante un proceso de invaginación de su membrana, creando una vesícula sin la mediación de autofagosomas (estudio)
- Autofagia mediada por chaperonas: es un proceso de degradación de determinadas proteínas dañadas del citosol, en el cual éstas atraviesan directamente la membrana de los lisosomas, sin que éstos tengan que engolfarlos en vesículas. Para atravesar la membrana las proteínas se unen a chaperonas, una heat-shock protein (estudio).
Estímulos para la autofagia
La autofagia puede ser estimulada por dos caminos principales:
El primero es mediante la inhibición de la vía m-TOR (de la cual hablaremos en el apartado dedicado a las proteínas). Un proceso de ayuno y limitación de nutrientes implicará la activación de la vía AMPK y la inhibición de la m-TOR, que conllevará la activación de la autofagia con el fin de obtener los tan necesarios nutrientes del reciclaje de las organelas defectuosas y de mantener la homeostasis (estudio).
En realidad, para ser precisos deberíamos decir que la autofagia se desencadena por diversas señales de estrés, y que la ausencia de nutrientes es la más habitual pero tal vez no la única: el estrés en el retículo endoplasmático debido a la acumulación de proteínas también puede desencadenarla (estudio).
El segundo es independiente de esa vía: la inhibición de la enzima inositol monofosfatasa conduce a una reducción del nivel de inositol y mioinositol, y potencia la autofagia. Drogas como el litio, la carbamazepina y el valproato hacen eso (estudio).
Posteriores estudios demostraron que esa vía está regulada por los niveles de calcio intracelular (que ya hemos estudiado), y que drogas como verapamil o clonidina también inducen la autofagia (estudio). Los elevados niveles intracitosólicos de calcio bloquean la autofagia, tanto si la vía m-TOR está activada como si no.
Es decir, la modulación de la autofagia puede ejercerse de manera local, no sistémica, específica en ciertas células o tejidos: no depende tanto de los niveles de activación sistémica de la vía m-TOR (modulados, como veremos, por el ayuno, las proteínas o, más específicamente, por ciertos aminoácidos) como de la modulación local, en ciertas células, de diversas moléculas, entre ellas su nivel de calcio intracelular.
Recordemos este hecho.
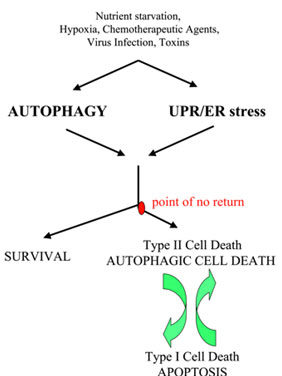
Autofagia: muerte o salvación
Algunos estudios parecen relacionar también la autofagia con algún tipo de muerte celular, aunque los datos son contradictorios.
Existen básicamente 3 tipos de muerte celular: necrosis, apoptosis y muerte por autofagia (aunque podrían añadirse formas complementarias de las que ya hemos hablado o hablaremos, como la anoikis, o apoptosis debida a las separación de una célula de la membrana extracelular, y que previene las metástasis; y la ferroptosis, o muerte desencadenada por la acumulación de ROS en las membranas lipídicas debida al exceso de hierro y a la ausencia de la enzima glutatión peroxidasa).
La apoptosis, como ya hemos visto, es el elegante mecanismo del suicidio celular, mediado por ROS y en el que intervienen factores diversos, externos o internos, en el más importante de los cuales intervienen especialmente las mitocondrias.
La necrosis es una 'muerte no programada' y, por tanto, mucho más 'dramática': por motivos diversos se produce la degradación de las membranas celulares y el vertido de sus contenidos a la matriz extracelular; se necesitará por ello la participación de factores inflamatorios para 'limpiar' y reciclar ese contenido. Por esa razón es siempre una muerte más indeseable.
La muerte por autofagia no está aún aceptada por todos los autores y la evidencia de su existencia es aún circunstancial.
Una posible explicación a esa duda de si existe la muerte por autofagia es que en ocasiones hay correlaciones entre autofagia y apoptosis, que pueden suceder a la vez y pueden desencadenarse por señales comunes: ambos procesos comparten algunas proteínas que bloquean igualmente la apoptosis y la autofagia (estudio) aunque la posible muerte por autofagia no depende, como sí lo hace la apoptosis, de la acción de las caspasas.
Por tanto, parece que la autofagia podría salvar o condenar a la célula y hay una posible explicación a esta paradoja: se han descubiertos dos posibles caminos para iniciar la macroautofagia (por lo tanto, dos tipos de macroautofagia), que emplean diferentes proteínas: autofagia canónica y no-canónica.
Para iniciar la autofagia clásica (o canónica) y formar los autofagosomas, se requiere reclutar 15 proteínas diferentes asociadas al proceso autofágico (ATG), pero la autofagia no canónica requiere para su inicio tan sólo un subconjunto de dichas ATG, y no requiere reclutar al resto, en especial la Beclin-1 (estudio), por eso a la autofagia no canónica se la conoce también como autofagia no dependiente de Beclin-1. Además, algunos estudios han encontrado que la autofagia no canónica utiliza sitios diferentes de la membrana celular para la formación del autofagosoma y no requiere de la creación de los fagóforos típicos de la autofagia canónica (estudio).
En ese caso, la sobreexpresión de Bcl-2, que se asocia a la Beclin-1 y que anula la autofagia inducida por escasez de nutrientes (canónica, NO asociada a muerte celular), no es capaz de anular la autofagia no canónica inducida por moléculas como el resveratrol, y que a la postre SÍ conduce a la muerte a las células tumorales.
Otros estudios y sustancias como trióxido de arsénico, gosssypol, estaurosporina o etoposido también inducen una autofagia no canónica asociada a muerte celular, generalmente apoptótica y a veces necrótica (estudio).
Tal vez ese camino autofágico diferente explique porqué en ocasiones la autofagia se asocia a muerte, mientras que en otras suponen la salvación para la célula (estudio) (aunque, antes de que cantemos victoria, y para complicar más el asunto, algunos estudios han descrito autofagias no canónicas asociadas a la salvación celular, no a su muerte).
Como quiera que sea, conseguir regular ambas autofagias en situaciones patológicas puede ser una estrategia de alto potencial terapéutico.
En general, como heurístico apresurado, la presencia de autofagosomas, indicadora de un proceso de degradación autofágica, tiene efectos citoprotectores. Bloquear la autofagia incrementa la susceptibilidad de las células tumorales a la apoptosis y promoverla tiene efectos (generalmente) citoprotectores (estudio), pero debemos tener presente que existe una sutil y compleja interrelación entre apoptosis y autofagia que impide hacer generalizaciones (estudio, estudio, estudio, estudio) y que el mantenimiento de las condiciones estresantes que promueven un nivel de autofagia citoprotectora puede desembocar, paradójicamente, en una muerte por autofagia (estudio). Matizaremos más adelante todos estos conceptos.
Autofagia y cáncer
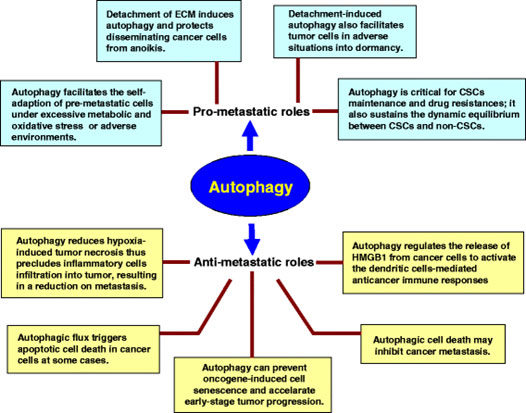
Por esas razones la autofagia es un arma de doble filo y tiene efectos paradójicos respecto al cáncer.
Algunos órganos como el cerebro, el hígado o el músculo dependen en gran medida de la autofagia para prevenir la acumulación de mitocondrias defectuosas y ya hemos comprobado la necesidad de mantener una adecuada salud mitocondrial. Cuando los niveles de autofagia son crónicamente bajos existe el riesgo de que la acumulación de proteínas y organelas defectuosas conduzca a todo tipo de problemas (estudio).
Además, la autofagia permite regular de forma más eficiente la homeostasis del hierro al degradar la ferritina (en presencia de determinadas proteínas llamadas cargo receptoras o NCOA4) y permitir la utilización intracelular del hierro. Cuando el nivel de las proteínas que permiten a los lisosomas degradar la ferritina es bajo, la ferritina permanece unida al hierro y éste no podrá ser utilizado. Es decir, la autofagia mejora la eficiencia en la utilización del hierro por las células. Recordemos también este hecho cuando nos ocupemos de la importancia del hierro para las células tumorales (estudio).
Hay evidencias de que cuando la autofagia es deficiente el proceso de carcinogénesis se facilita y se desarrollan tumores con mayor facilidad. Pero, y esto es muy importante, los tumores que nacen en un entorno donde la autofagia está impedida o dificultada, no alcanzan un fenotipo agresivo y permanecen como tumores de bajo grado (estudio).
La autofagia previene la inflamación, previene el estrés oxidativo, modula la respuesta inmune (y es muy importante en numerosas estirpes del sistema inmunitario) y (aunque aquí las cosas no están tan claras) previene la metástasis (estudio). La autofagia parece ser un arma que emplean también extensivamente las células del sistema inmune para luchar contra las amenazas, sobre todo en células dendríticas, o para mantener la homeostasis en los linfocitos T, especialmente en los de estirpe TH1 y sus citoquinas, dedicados a la defensa antitumoral (estudio, estudio).
Dicho de otra forma: la autofagia es una excelente forma de impedir el inicio de cualquier cáncer al realizar una limpieza de mitocondrias y otras organelas defectuosas y asegurar una correcta homeostasis celular, pero en cánceres ya establecidos la autofagia tumoral es un medio por el cual las células tumorales aseguran su supervivencia (estudio).
Los efectos contradictorios de la autofagia no sólo se demuestran en el inicio y desarrollo del cáncer sino también en lo relativo al proceso de metástasis (estudio), aunque debemos considerarla un enemigo antes que un aliado cuando el cáncer ya se ha establecido y un factor eminentemente promotor y facilitador de las metástasis (estudio)
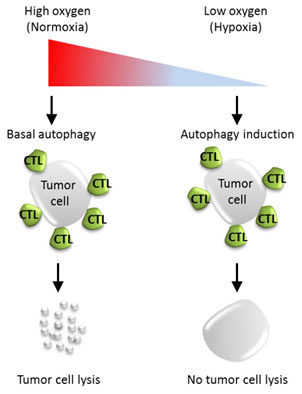
La hipoxia (habitual en las zonas del tumor habitadas por las células con fenotipos más malignos), acelera además la autofagia. Algo lógico, porque la mala irrigación tumoral impide la llegada de nutrientes, lo que obliga al tumor al 'canibalismo' autofágico para asegurar su viabilidad (estudio).
La lucha contra la hipoxia, que abordaremos más adelante, debe tener en cuenta también este hecho, porque puede que la hiperautofagia hipóxica esté detrás de la típica resistencia a los fármacos de los tumores que habitan zonas poco oxigenadas. No sólo eso, sino que permite al tumor evadir eficientemente al sistema inmunitario y, en concreto, a los linfocitos T CD8+, fundamentalmente citotóxicos.
Adicionalmente -todo está relacionado-, la autofagia establece una 'conversación' retroalimentada con el proceso de la glutaminólisis tumoral del que hablaremos también más adelante (estudio, estudio) y entenderemos los mecanismos por los cuales ambas se potencian. Esa combinación de autofagia y glutaminólisis puede ser una de las vías por las cuales las células tumorales resisten a los fármacos y recidivan pese a todos los esfuerzos terapéuticos.
Una razón más para no caer en el reduccionismo y creer que hemos encontrado el 'santo grial' en determinado proceso que parece de importancia capital: es la sinergia entre terapias combinadas que actúen sobre numerosos 'puntos de presión' la que podrá aportar soluciones definitivas.
Ya hemos visto que la autofagia es generalmente protectora para los cánceres ya establecidos, pero también que se han encontrado correlaciones entre autofagia y muerte celular. También hemos visto que existen dos formas de macroautofagia y que una de ellas, la no-canónica, está asociada con mayor frecuencia a apoptosis o necrosis. No es extraño, por tanto, que encontremos multitud de sustancias antitumorales que parezcan usar la autofagia como mecanismo terapéutico, pero por medios aparentemente contrapuestos: algunos la potencian y otros la inhiben. Tal vez debido a que los primeros facilitan la autofagia no canónica o a que potencian la autofagia de forma excesiva, que sobrepasa las capacidades degradativas y metabolizadoras de la célula tumoral (estudio).
Hay multitud de estudios que abundan en dicha contradicción. Tal vez nos aporten datos con los que establecer hipótesis interesantes:
Autofagia como protectora tumoral
- Inhibición de autofagia impide progresión de glioblastoma, demostrando su papel citoprotector (estudio)
- La inhibición de autofagia multiplica la capacidad antitumoral del Paclitaxel (estudio)
- La inhibición de la autofagia puede bloquear la migración celular y las metástasis del cáncer de mama (estudio)
- Inhibición del nivel basal de autofagia en células de cáncer de vejiga induce apoptosis (estudio)
- Eficacia antiglioma de la combinación de ciertos antidepresivos y anticoagulantes al incrementar excesivamente la autofagia (estudio)
- Muerte autofágica asocida a catepsinas lisosomales (estudio)
- Hipótesis de sutil equilibrio de señales y proteínas: a partir de un determinado nivel, los autofagosomas sobrepasan la capacidad de la célula y pueden derivar directamente bien en muerte por autofagia (tipo II), o bien desencadenar respuestas de apoptosis (muerte celular tipo I) o necrosis (muerte tipo III) (estudio)
- Sólo la inhibición de últimas etapas de autofagia con cloroquina, uno de los más conocidos inhibidores, hizo sinergia con sustancias potenciadoras de autofagia en células de glioblastoma (estudio).
- En otro estudio, las células de glioma fueron expuestas a imatinib y a inhibidores de diferentes fases de la autofagia. Los inhibidores de fases tempranas redujeron en realidad la citotoxicidad tumoral del imatinib, mientras que los inhibidores de etapas tardías, enfocadas en los lisosomas, incrementaron su efectividad (estudio)
- La quercetina parece ejercer sus efectos terapéuticos de forma pleiotrópica, pero sobre todo al inhibir la autofagia en últimas etapas en células de gliomas (aunque en otros estudios se considera la quercetina como un potenciador de autofagia) (estudio)
Lo que deducimos de esto son dos cosas:
- Que debemos utilizar también sustancias sinérgicas que potencien el sistema inmune de la forma "correcta", tal y como hemos investigado en el capítulo dedicado a él
- Que debemos averiguar cómo llevar al tumor, y SÓLO al tumor, determinadas moléculas con efectos sistémicos, que deseamos estén restringidos al ambiente tumoral y no a las células sanas. Hay maneras relativamente sencillas y baratas de conseguir este resultado, aunque muchas veces esto último no será necesario, debido al efecto diferencial que dichas moléculas ejerecen sobre células tumorales y sanas.Y a veces debemos emplear tales sustancias para conseguir simplemente que las moléculas terapéuticas alcancen el tumor o de otro modo no podrían penetrar en zonas neoplásicas, inalcanzables debido a las particularidades de la red vascular aberrante que los nutre o a la barrera que el microentorno ácido levanta.
Los lisosomas no son sólo vesículas dedicadas exclusivamente a la degradación de organelas, proteínas y patógenos, sino que interpretan un papel metabólico en estrecha comunicación con las mitocondrias (estudio). El vertido del contenido lisosomal, lleno de enzimas hidrolasas, puede conducir a la muerte celular, bien de forma programada o bien accidental, por alguna intervención externa. Este hecho puede ser aprovechado terapéuticamente.
Ya hemos visto que es la inhibición de últimas etapas de la autofagia la que ejerce mayores efectos terapéuticos, es decir, cuando se actúa sobre la acción degradativa de los lisosomas. Por lo tanto, las drogas que apuntan específicamente sobre la acción lisosomal (lisosomotróficos) podrían tener efectos anticáncer.
Para entender su mecanismo específico de acción entendamos la relación de los lisosomas con el ph celular, un tema de extraordinaria importancia, en el que profundizaremos más adelante, que también tiene una gran relación con la resistencia tumoral a los fármacos. De momento lo explicaremos de forma sucinta.
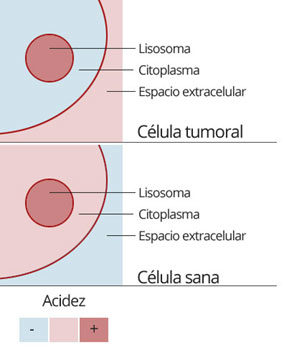
Los lisosomas contienen enzimas en un estado inactivo, que se activan al ponerse en contacto con los elementos que deben ser degradados. En esa activación tiene gran importancia el ph, que debe ser ácido, alrededor de 5, mientras que el citoplasma se mantiene relativamente más alcalino.
Las células sanas tienen un ph intracelular más ácido que su entorno extracelular, pero ese gradiente es inverso en las células tumorales: la producción de lactato tumoral debido al exceso de fermentación de la glucosa, que debe expulsarse para prevenir la excesiva acidificación del citoplasma, hace que el interior de la célula tumoral sea más alcalina que el exterior (estudio).
En ese interior relativamente alcalino deben sobrevivir unos lisosomas que siguen necesitando acidez para ejercer su labor y que la maquinaria de la autofagia (que tanto necesitan para sobrevivir cuando hay escasez de otros nutrientes) no se detenga.
La propia acidez extratumoral (y alcalinidad intratumoral) parece conducir a una mayor autofagia (estudio), y la autofagia puede ser un mecanismo adaptativo a entornos con ph crónicamente ácido (estudio).
Por tanto, combinar la alcalinización del entorno tumoral con la de los lisosomas y con la acidificación del citoplasma tumoral podría tener efectos terapéuticos sinérgicos. Y es necesario combinar estas estrategias porque, por ejemplo, la efectividad de la cloroquina al inhibir la autofagia se ve dificultada cuanto mayor sea la acidez del microentorno extratumoral (estudio).
El gradiente de ph entre los lisosomas y el citoplasma es por tanto más acusado en las células tumorales que en las sanas, y juega un importante papel en la resistencia a algunos fármacos, que actúan sólo cuando el ph es relativamente alcalino o débilmente ácido (el tema de la multirresistencia lo trataremos en profundidad más adelante): algunos fármacos se acumulan específicamente en los lisosomas, que los 'atrapan' en su interior ácido y desactivan su capacidad citotóxica. Se sabe que a mayor grado de secuestro lisosomal, mayor resistencia a fármacos como el Sunitinib.
Esa acumulación conlleva además la biogénesis de nuevos lisosomas. Cuando se actúa sobre las H+ATPasas vacuolares con fármacos como la Bafilomicina A1 y se manipula el intercambio de protones en la membrana de los lisosomas, estos se alcalinizan, pierden su capacidad de atrapar la droga y pueden verter de nuevo al citoplasma el contenido de la quimioterapia acumulada, restableciéndose su capacidad citotóxica (estudio).
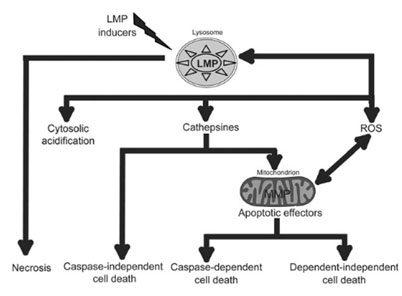
Además, ya hemos dicho que los lisosomas pueden intervenir en la muerte celular mediante la permeabilidad de la membrana lisosomal (LMP) y el vertido de las enzimas proteolíticas que contiene. Las proteasas implicadas en la muerte celular al cambiar la permeabilidad de la membrana se llaman catepsinas, una familia de enzimas, algunas de las cuales aún permanecen activas a ph relativamente poco ácido como el del citoplasma.
Éstas inducen una acidificación en el citoplasma que puede conducir a una necrosis (estudio), aunque la cascada de sucesos que se desencadena puede inducir también una apoptosis con o sin la intervención de las caspasas mitocondriales.
Por lo tanto, la inducción de permeabilidad en la membrana lisosomal de las células cancerígenas mediante drogas es un objetivo terapéutico de triple acción:
- Combate la multirresistencia a la quimioterapia
- Impide la autofagia tumoral citoprotectora, lo cual puede conducir a la muerte celular
- Induce directamente algún tipo de muerte celular al verter catepsinas al citoplasma y al acidificarlo: necrosis o apoptosis
Se ha observado incluso una diferencia sustancial de posición y comportamiento entre los lisosomas tumorales y los de las células sanas. Los lisosomas tumorales incrementan la síntesis de proteasas y parecen situarse en posiciones más cercanas a la membrana celular, en vez de cercanas al núcleo, lo que facilita que puedan verter al espacio extracelular catepsinas que, como hemos visto, facilitan las metástasis (estudio).
Las catepsinas podrían explicar, además del lactato, la típica acidez del espacio extratumoral (limitada al microambiente tumoral, no confundamos con acidosis metabólica sistémica) (estudio). Esto podría ser un considerable problema si forzamos la permeabilización de los lisosomas tumorales pero las catepsinas se vierten fuera de la célula en vez de dentro, en el citoplasma.
Hay que tener en cuenta, además, que numerosas enfermedades degenerativas correlacionan con inestabilidad lisosomal, caracterizada por una diferente permeabilidad de sus membranas. Si bien es cierto que, en células de comportamiento tan "extremo" como las tumorales, cualquier desestabilización puede conducir a una cascada catastrófica de sucesos, lo cual las convierte (en contra de lo que suele pensarse) en mucho más frágiles que las células normales, las intervenciones con drogas que apunten a los lisosomas pueden producir efectos secundarios indeseados. No obstante, numerosos estudios sugieren que las células tumorales son mucho más susceptibles a la permeabilización de la membrana lisosomal que las sanas (estudio).
Para manipular la permeabilidad de las membranas hay que enfocarse en los canales iónicos, que son probablemente una de las piezas más decisivas en el tratamiento del cáncer, al incidir en la regulación del ph que es, a su vez, un elemento clave en glucólisis, acidificación extracelular o autofagia. Uno de los iones más importantes es el cloro (Cl-), cuyos niveles controlan el grado de acidez en los lisosomas y, por tanto, su operatividad: mayores niveles de cloro intralisosomal se asocian a mayor acidez de los lisosomas y mayor autofagia citoprotectora. Bajar los niveles de Cl- en los lisosomas puede ser una medida terapéutica (estudio).
Estudiaremos más extensamente este importante tema de los canales iónicos y su manipulación en otro apartado de este capítulo del libro.
Es probable que detrás del efecto antitumoral de ciertos compuestos que parecen potenciar la autofagia se oculte también un cambio de permeabilidad de la membrana lisosomal, lo que explicaría los resultados aparentemente paradójicos y el efecto citotóxico de la autofagia potenciada.
El caso de algunos cannabinoides como el THC es paradigmático de este hecho: promueven la autofagia, pero modifican el ratio de dihidoceramidas:ceramidas en la membrana de los lisosomas tumorales y, por tanto, la desestabilizan, incrementan su permabilidad e inducen la muerte de la célula tumoral que las contiene, sin efectos secundarios análogos en las células sanas (estudio).
Fármacos y suplementos que actúan sobre la autofagia
En este apartado nos enfocaremos en algunas sustancias naturales o sintéticas cuya acción antitumoral parece estar mediada principalmente por su efecto sobre la autofagia.
El listado podría ser enorme, si contamos todas las moléculas que cuentan con el soporte de algún estudio, al menos preclínico. Algunas son difíciles de obtener, otras presentan efectos secundarios considerables y otras están en fase experimental; pero otras son sencillas de conseguir, baratas y sin efectos secundarios apreciables.
Algunos compuestos presentan características contradictorias según el estudio consultado: mientras que algunos los consideran inhibidores, en otros son potenciadores de autofagia.
Este listado limitado muestra que las opciones son abundantes y lo que falta no es ciencia básica sino dinero para ensayos que permitan trasladar las moléculas más adecuadas (de mayor potencial terapéutico, no de mayor potencial económico) a la práctica clínica.
Es un listado que no profundizará excesivamente. Las sustancias más interesantes serán tratadas de forma más extensa en el apartado dedicado a las acciones prácticas.
Ya hemos visto que la aparente paradoja de los potenciadores de autofagia que presentan acción antitumoral puede resolverse considerando su paralela acción lisosomotrópica, al manipular la permeabilidad de la membrana de los lisosomas.
Esa característica puede estar también presente en algunas drogas que inhiben la autofagia, como la cloroquina, así que las clasificaciones que vamos a hacer no son estáticas y algunas moléculas pueden pertenecer a varias categorías.
Potenciadores de autofagia con capacidad antitumoral / lisosomotrópicos
- Nimbolide: hablamos ya de él en el apartado dedicado a la microbiota, en el que resaltamos los magníficos resultados antitumorales que arrojaba en algunos estudios con animales. Es uno de los compuestos más potentes probados en pruebas preclínicas (estudio), aunque no puede encontrarse fácilmente aislado, sino en suplementos de extracto de Neem. Que aún permanezca en el limbo terapéutico es una aberración.
- Resveratrol: polifenol que induce autofagia al inhibir la vía m-TOR. Se creía que se necesitaban altas cantidades para producir efectos terapéuticos, pero su traslado a dosificaciones humanas a partir de los estudios en ratones revela que pueden alcanzarse dosis adecuadas usando suplementos comerciales (estudio)
- Cannabinoides: hablaremos más extensamente de ellos más adelante. Numerosas pruebas están arrojando resultados magníficos, en solitario o en combinación con quimioterapias como temozolamida (estudio)
- Minerval (2-hidroxioleato): un compuesto que actúa sobre los esfingolípidos y la diferente estructura lipídica de las membranas celulares tumorales y sanas, algo que abordaremos más adelante, pero que puede basar también su eficacia terapéutica en la inducción de muerte por autofagia (estudio). El equipo está obteniendo numerosos éxitos en ensayos en fases I y IIb y en reportes anecdóticos, y acaba de recibir financiación de la Unión Europea para avanzar en ensayos más amplios. Sus creadores fueron linchados en los medios españoles en un esperpéntico ejercicio de deshonestidad y estupidez, entre otras razones porque ofrecían online el fármaco en forma de suplemento alimenticio, llamado Oleate Plus (la molécula es un ácido oleico similar al del aceite de oliva, y por tanto totalmente inocua). Una persona del grupo de Cáncer Integral ha controlado de forma sorpresiva el glioblastoma de su madre tras usarlo, pero el resultado del tribunal inquisidor ha sido que han dejado de vender el suplemento.
- Evodiamina: alcaloide aislado de la planta evodia rutaecarpa, que promueve la autofagia asociada a muerte celular en numerosos tipos de cáncer y que ha demostrado sinergia con inhibidores de autofagia como 3-metiladenina (estudio, estudio)
- Magnolol: es un lignano procedente de la corteza de especies como Magnolia oficinalis y que ha demostrado prometedores resultados en numerosos estudios, al igual que otra molécula aislada de la misma planta: honokiol. Induce muerte celular, al parecer, por un exceso de autofagia (estudio)
- Curcumina: el omnipresente grupo de moléculas con más de 90 objetivos terapéuticos también incide en la autofagia. Hemos hablado de ella en el apartado dedicado al Sistema Inmune y la microbiota, y profundizaremos aún más en el apartado práctico de este capítulo dedicado al metabolismo tumoral (estudio). Su biodisponibilidad es muy baja y su farmacocinética muy rápida, así que se necesitan preparaciones que aseguren la eficacia terapéutica: liposomas, nanopartículas o aplicaciones intravenosas. Muchos otros estudios demuestran, como ya hemos visto anteriormente, la sinergia que ejerce con inhibidores de últimas etapas de la autofagia.
- Otros interesantes potenciadores de autofagia citostática: quercetina, itraconazol, ivermectina, capsaicina (aunque en algunos estudios parece que la inhibe).
- Pequeñas moléculas de origen natural, potenciadores de autofagia con efectos antitumorales: (estudio, listado)
- Estudio con otro listado de activadores de muerte celular ligada a autofagia (estudio)
- Otro listado más de potenciadores (estudio, listado)
- Timoquinona: hemos hablado ya extensamente de ella en el capítulo dedicado a la microbiota, pero aún le dedicaremos más espacio en este mismo capítulo debido a su importancia, tal vez al mismo nivel que Nimbolide, pero en este caso inhibiendo las últimas etapas de autofagia (aunque algunos estudios dicen que en realidad la promueve). Por lo tanto ambas moléculas son potencialmente sinérgicas. Sus propiedades antitumorales son amplias y arroja muy buenos resultados preclínicos pero, de nuevo, al igual que Nimbolide, no puede ser patentada y, por tanto, no será fácilmente trasladable a la práctica clínica (estudio). Puede encontrarse como componente, entre otras interesantes moléculas, en las semillas del comino negro (nigella sativa), sobre todo en forma de aceite. Sabe muy mal pero pueden alcanzarse dosis terapéuticas por vía oral.
- Cloroquina e hidroxicloroquina: inhibidores típicos de autofagia, aunque algunos estudios ponen en duda que su efectividad antitumoral se base en este hecho, al presentar una inhibición autofágica débil. Hablaremos más adelante extensamente de ella. La hidroxicloroquina tiene menores efectos secundarios, y su adición al estándar de quimioterapia con temodal ha conseguido en algunos ensayos clínicos aumentos de supervivencia en pacientes de glioma maligno, aunque en otros no se obtuvieron resultados tan esperanzadores (estudio). Es fácil de conseguir y de aplicar, con escasos efectos secundarios.
- Luteolina: flavona habitualmente presente en numerosas frutas y hierbas. Los estudios son contradictorios: mientras algunos consideran que promueve a autofagia otros proclaman que la inhibe. La incluimos por sus considerables efectos antitumorales en ensayos preclínicos y porque no son tan abundantes los inhibidores naturales como los potenciadores de autofagia (estudio). Puede encontrarse en algunas formulaciones comerciales, fáciles y baratas de conseguir, y ha demostrado sinergia con otro flavonoide relativamente sencillo de obtener en presentaciones orales, la silibinina (estudio)
- Pyrvinium Pamoato: droga antiparasitaria (su objetivo son los helmintos) que inhibe la autofagia y hace sinergia con drogas antiglucolíticas y proautofagia como 2-desoxiglucosa (estudio, estudio)
- Lys05: droga en experimentación, que se acumula en los lisosomas y los alcaliniza, bloqueando su capacidad degradativa del autofagosoma. En ratones, su capacidad para inhibir la autofagia es 10 veces más potente que la hidroxicloroquina, y produce como agente único unos considerables efectos antitumorales a dosis que no son tóxicas. Uno de los fármacos más prometedores, por su posible letal sinergia con quimioterápicos y potenciadores de autofagia.
- Amiloride: antiguo fármaco diurético que no es exactamente un inhibidor de la autofagia, pero que actúa como un modulador general del ph al incidir en los intercambiadores de sodio-hidrógeno (estudio). Eso implica que actúa específicamente en entornos ácidos como los característicos del microentorno tumoral, impidiendo el intercambio de protones y dificultando dicha acidificación, lo cual implicaría que el interior de la célula tumoral no podría alcalinizarse. Recordemos la sinergia de esta acción con otro tipo de moléculas, tanto quimioterápicos como potenciadores de la autofagia (estudio). Dentro la célula tumoral es posible que actúe sobre los niveles lisosomales del cloro, desactivando su potencial e incidiendo parcialmente sobre la autofagia.Sus derivados más potentes, algunos en experimentación, muestran una enorme capacidad antitumoral al incidir en el factor determinante del ph desregulado tumoral, del que nos ocuparemos más extensamente en este capítulo.
- Bafilomicina A1: antibiótico que actúa en los niveles de ATPasa vacuolar, disminuye los niveles de cloro intralisosomal y eleva el ph dentro de los lisosomas, desactivando su capacidad degradativa e impidiendo que se consume la autofagia (estudio). De nuevo comprobamos que la relación entre ph de los distintos "escenarios" tumorales (extratumoral, intratumoral y lisosomal) es de enorme trascendencia y su manipulación tiene gran importancia terapéutica.
- Otros inhibidores: elaiophylin, 3-metiladenina, leupeptin , etc. (listado)
El listado es enorme y abre un potencial terapéutico que, de momento, permanece desaprovechado debido al sistema de ensayos clínicos, elementos prácticos que emborronan el resultado del mundo ideal en el que los cientificistas creen que habita la "Ciencia".
Estrategias terapéuticas combinadas basadas en acciones sobre la autofagia
Estudiaremos en profundidad la vía PI3K/Akt/mTOR y su extrema importancia con respecto al cáncer en otro capítulo del libro. De forma sucinta: m-TOR es un regulador maestro de la autofagia, y ambos funcionan en forma de par (las cosas nunca son tan sencillas, basta ver este diagrama para entenderlo, pero de momento quedémonos con este heurístico), aunque ya hemos visto que hay caminos de activación de la autofagia que no dependen de esa vía.
En general la vía m-TOR es un sensor nutricional, que al desactivarse lanza señales de estrés celular cuando hay carencia de nutrientes y pone en marcha el mecanismo citoprotetor de la autofagia (estudio).
La vía m-TOR se desactiva con el ayuno; en concreto, con la restricción de proteínas y, sobre todo, de determinados aminoácidos como leucina y metionina. Abordaremos el tema de las proteínas y los aminoácidos más adelante, porque la cantidad absoluta y relativa de proteínas consumidas en la dieta, así como el ratio de determinados aminoácidos tiene una importancia mucho mayor de la que usualmente se le concede, por delante de los porcentajes de hidratos de carbono y grasas que suelen protagonizar los "debates" en foros y redes sociales.
Respecto al cáncer, y de nuevo explicado de forma breve y sucinta: m-TOR es un "señalizador maestro" de crecimiento, que moviliza recursos anabólicos. Su conexión con el cáncer está demostrada, y su sobreexpresión es una MUY mala noticia si uno padece la enfermedad (estudio). También está ligado al envejecimiento y a otras enfermedades.
Nada que la naturaleza haya creado es "bueno" o "malo" en términos absolutos, casi todo tiene su contrapartida, que lo modula en forma de algo parecido a un par de acción, formando dúos de "interruptores" que acentúan o amortiguan determinados caminos bioquímicos. Es una manera simple de explicar procesos de gran complejidad, pero que sirve para entender el concepto: m-TOR y autofagia forman uno de esos pares.
No podríamos vivir si se anulase por completo la vía m-TOR, pero generalmente menos es más. La inactivación periódica de la m-TOR activa la autofagia que, en individuos sanos, suele conducir, como ya hemos visto, a una mejora de la homeostasis y la eliminación de organelas y proteínas defectuosas y hasta de patógenos indeseados.
Numerosas moléculas inhibidoras de la vía m-TOR (sintéticas o naturales) han demostrado su efectividad antitumoral, pero son el ayuno y el ayuno intermitente los medios más sencillos para obtener las ventajas de dicha inhibición, al despertar el mecanismo depurador de la autofagia.
Si no padecemos cáncer, el ayuno tal vez sea una de las armas más sencillas y efectivas de prevenir la enfermedad. Una potentísima y gratuita forma de ganar calidad y cantidad de vida.
Si padecemos la enfermedad, las cosas se complican: el cáncer puede aprovecharse tanto de las señales anabólicas de la vía m-TOR como de los efectos citoprotectores de la autofagia cuando hay escasez de recursos. No sólo eso sino que, como ya hemos visto, pueden combinarse ambos procesos puesto que la autofagia puede activarse por caminos ditintos a los de la vía m-TOR.
Por lo tanto, el ayuno en pacientes de cáncer es de nuevo imprescindible, pero sólo como forma de restringir los recursos metabólicos del tumor e inhibir las señales anabólicas de la vía m-TOR, porque la autofagia aumentada al seguir esta vía podría ser citoprotectora. Algunos sostienen que en el caso del cáncer el ayuno podría promover un "exceso" de autofagia, que desembocaría en muerte celular, pero eso no está del todo claro.
Deducimos que habrá que combinar una dieta muy bien pensada (que aúne la densidad nutricional con el ayuno intermitente y la restricción de piezas clave que promueven la vía m-TOR), con acciones adicionales que ataquen otras muchas vías metabólicas que benefician al tumor, con la autofagia como elemento central (además de otras como la glutaminólisis, la síntesis de ácidos grasos, etc, y que abordaremos más adelante).
Esta estrategia ha sido avalada en bastantes estudios, que encuentran sinergia antitumoral al combinar la inhibición de la vía m-TOR con la de la autofagia (estudio).
Además, hemos visto que el abordaje de la autofagia como tratamiento antitumoral se optimiza al combinar un potenciador de autofagia (que haya demostrado conducir a la muerte a la célula) con un inhibidor de últimas etapas de autofagia.
Con todos esos datos, parece razonable proponer esta estrategia a un enfermo de cáncer:
- Dieta cetogénica que se concentre como pieza clave en la cantidad de proteínas y en el ratio de ciertos aminoácidos (repito: abordaré MUY extensamente este tema clave más adelante).Y cuando uno se concentra en las proteínas y en el ratio de aminoácidos se sorprenderá al ver que no hay porqué alcanzar abominables porcentajes de grasa que aporten el 80-90% de las calorías y la dieta pasa a ser más razonable, más "normal" y, sobre todo, nutricionalmente más densa.
- Ayunos estratégicos completos, sobre todo los días alrededor del tratamiento de quimio a dosis altas, para potenciar sus efectos terapéuticos y minimizar sus efectos secundarios.
- Ayuno intermitente que minimice la m-TOR.
- Al menos un fármaco o suplemento que potencie la autofagia citotóxica. En un mundo ideal tal vez sería Nimbolide intravenoso. En este mundo hay que encontrar la solución que se adapte a nuestra disponibilidad económica.
- Al menos un fármaco o suplemento que inhiba las últimas etapas de la autofagia. En un mundo ideal tal vez sería Timoquinona intravenosa o Lys05. En este, tal vez hidroxicloroquina o cualquier otro que se adapte a nuestra posibilidades.
- Tal vez otros fármacos que bloqueen la autofagia con mecanismos complementarios, el más importante de los cuales es la regulación del ph de los distintos "escenarios" tumorales: Amiloride u otros aún más útiles.
De eso va este libro. A lo mejor alguien más encuentra razonable este planteamiento.



Comentario: No olviden pasarse por la web de este autor, Cáncer Integral, para más información sobre tratamientos contra el cáncer.