© DesconocidoCélula cancerosa separándose
Aunque hay una posible luz al final del túnel.
En primer lugar hay que tener en cuenta que matar células cancerosas no es difícil. Los doctores han sabido cómo hacerlo desde hace más de 100 años. La pregunta es cómo matar células cancerosas sin matar a las células sanas, lo cual parece ser prácticamente imposible.
En este artículo exploraremos la teoría del doctor Peter Attia, presidente de la Nutrition Science Initiative, que describe de forma sencilla el crecimiento canceroso y a la vez explora una posible forma de minimizarlo.
En 1924, un científico llamado Otto Warburg descubrió algo desconcertante:
las células cancerígenas, incluso en presencia de oxígeno suficiente, tenían un tipo de metabolismo reservado para células que requieren energía de forma rápida: metabolismo anaeróbico. De hecho, incluso cuando a las células cancerígenas se les daba un extra de oxígeno, recurrían de forma prácticamente exclusiva a la glucosa para hacer ATP por la ruta anaeróbica. Esto es desconcertante porque la vía anaeróbica suele ser el último recurso para las células, no su estrategia por defecto.
Esto nos lleva a la siguiente pregunta ¿las células cancerosas hacen esto porque es lo único que pueden hacer o "eligen" hacerlo a propósito?
Esto se comprueba en la mitocondria de las células cancerosas.
La mayoría de cánceres parecen tener defectos en la mitocondria que les impiden llevar a cabo el metabolismo aeróbico.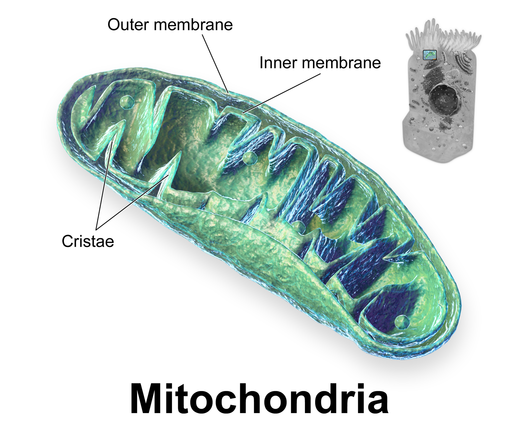
© Desconocido
Esto puede ser porque las células cancerosas, como cualquier célula que esté reproduciéndose sin parar, puede que estén optimizadas para algo más que la generación de energía (ATP). Puede que estén optimizadas para acceder repetidamente a los materiales necesarios para permitir este crecimiento casi infinito.
En este caso, un cáncer preferirá absorber rápidamente glucosa. En el proceso, generará la energía que necesita, pero lo que es más importante, ganará acceso a muchos átomos de carbón, hidrógeno y oxígeno (de la descomposición de glucosa). Estos átomos les sirven como aporte al mayor escoyo para su supervivencia, el crecimiento.
La selección natural de las células cancerosas se basa en esta habilidad de crecer sin parar accediendo a la máxima cantidad de substrato celular posible.Otra explicación sería que las células cancerosas son células con un defecto en el ADN, que parece que da como resultado la desactivación de algunos genes (los que evitan el crecimiento tumoral) y la activación de otros (los que promueven el crecimiento celular descontrolado). Entre otras cosas, este daño en el ADN también daña la mitocondria, haciendo que las células cancerosas no puedan llevar a cabo la
fosforilación oxidativa. Así que tienen que usar el metabolismo anaeróbico para generar ATP.
Sea cual sea la explicación más acertada, el resultado parece ser el mismo:
las células cancerígenas utilizan glucosa de forma casi exclusiva para producir ATP. Lo que significa que tienen una peculiaridad metabólica.
Independientemente de a cuánto oxígeno y ácidos grasos tengan acceso, prefieren usar glucosa para producir ATP ¿Se puede usar esta información para tratar o incluso prevenir el cáncer?
© Desconocido
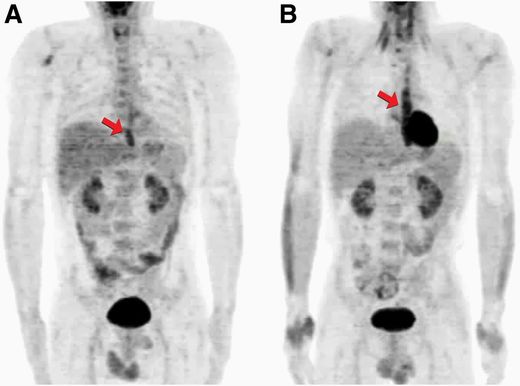
Una forma de explotar esta peculiaridad que se ha hecho durante muchos años en medicina es con los escáneres FDG-PET, que pueden detectar un cáncer de forma no invasiva, aprovechándose el consumo obligado de glucosa de las células cancerígenas.
Como vamos viendo la pregunta que surge es
¿qué pasa si reducimos la cantidad de glucosa en el cuerpo? ¿Podría esta medida "matar de hambre" a las células cancerígenas? Una revelación sobre esto vino hace poco tiempo de un sitio inesperado: el estudio de pacientes con diabetes tipo 2.
En los últimos años, tres estudios en pacientes tomando un medicamento llamado metformina han mostrado que las personas que la toman parecen padecer menos cánceres.
Y cuando tienen cáncer, sobreviven durante más tiempo.
Esto parece ser debido a la actuación de la metformina, que tiene muchos efectos pero uno de los principales es activar una enzima llamada AMP quinasa, que reduce la producción de glucosa en el hígado (el hígado crea glucosa a partir de proteínas y glicerol). Este medicamento se usa en pacientes con diabetes para reducir los niveles de glucosa y por lo tanto la necesidad de insulina.
Así que los pacientes que toman metformina puede que tengan menor incidencia de cáncer porque sus niveles de glucosa son menores, o porque necesitaban menos insulina.
La insulina y el factor de crecimiento insulínico (igf-1) parece que también tiene un rol importante en el crecimiento del cáncer como ha sido demostrado recientemente en la observación de que
personas con receptores de IGF-1 defectuosos parecen ser inmunes al cáncer. O puede ser que la activación de la quinasa AMP en las células cancerígenas las daña de otra forma. No sabemos por qué, pero lo que sabemos es que donde hay humo hay fuego. Y el humo en este caso es que un medicamento aparentemente inocuo que altera los niveles de glucosa parece interferir con el cáncer.
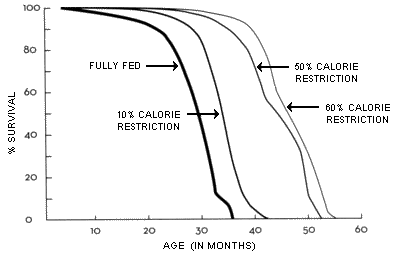
© Desconocido
. Aunque históricamente, esta observación se ha interpretado como menos "comida" para el cáncer, una mejor explicación es que una restricción calórica suele ser sinónimo de una reducción de glucosa, y la restricción de glucosa sea la que mantenga el cáncer a raya.
Afortunadamente, este cambio de paradigma en oncología (explotar la anormalidad metabólica de las células cancerosas) está ganando popularidad, y está siendo estudiada por los mejores doctores y científicos de esta especialidad.
Alrededor de una docena de estudios se están llevando acabo ahora mismo investigando esta estrategia en los cánceres que parecen más sensibles a este efecto metabólico (cáncer de mama, de endometrio, cervical, de próstata, pancreático, de colon...). Algunos de estos estudios simplemente están intentando repetir el efecto de la metformina, mientras que otros están buscando otros métodos más sofisticados, como afectar al
PI3K).
Actualmente, ningún estudio en humanos está evaluando el efecto terapéutico de una reducción de glucosa o insulina por la vía dietética, aunque puede que esto cambie en un año o dos, dependiendo de los estudios sobre la metformina.
Comentario: Si bien es evidente que hacen falta más estudios al respecto, la investigación antropológica, biológica y médica con respecto a lo que es una dieta saludable para el ser humano muestra, cada vez más, que nuestros cuerpos están adaptados para una dieta baja en carbohidratos (que se convierten en glucosa en el cuerpo). De hecho, no existe necesidad alguna de consumir carbohidratos, ya que el cuerpo mismo es capaz de generar toda la poca glucosa que necesita para algunos tejidos, y su consumo en exceso es más bien perjudicial a la salud, ya que altera el metabolismo de las mitocondrias y, por ende, del cuerpo en general, creando todo tipo de desbalances en el organismo humano.
Hoy en día, debido a nuestro alto consumo de glucosa, la ciencia convencional considera que la única forma de metabolismo es la llamada glucólisis, que utiliza la glucosa para producir ATP. Sin embargo, durante casi 3 millones de años, en la llamada era Paleolítica, nuestros antepasados vivieron en el estado de cetosis, es decir, la quema de cuerpos cetónicos para producir ATP. Resulta que la cetosis constituye una forma de metabolismo mucho más eficiente y al parecer, es el estado natural al que nuestros cuerpos están adaptados, por lo que, al llevar una dieta cetogénica (generadora de cuerpos cetónicos), el cuerpo parece restablecerse y se resuelven muchos de los problemas de salud relacionados a la civilización moderna.
Les invitamos a leer más al respecto:
- La dieta cetogénica - Una visión general
- La dieta paleolítica revisada
- La cetosis es el estado fisiológico óptimo del ser humano
- ¡Gracias Cetosis! (Parte 1) (Parte 2) (Parte 3)
- Dieta cetogénica I
- Dieta cetogénica II
- Los Beneficios de la dieta cetogénica y su papel en el tratamiento contra el cáncer
- La dieta cetogénica podría ser la clave para recuperarse del cáncer